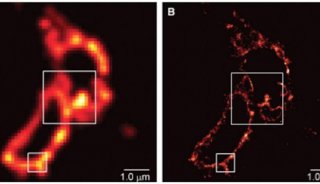
分析细胞学技术-1
分析细胞学是从定量的角度对细胞的各种形态学参数、生物学特征、细胞生化成分的组成及含量以及细胞的各种功能等进行研究,将以往各种细胞学技术从定性、定位进一步发展到定量的研究,获得定量的测量数据,以更客观地揭示生命活动的规律。分析细胞学技术的发展有两个主要领域,固定式细胞分析和流动式细胞分析。固定式细胞分析是指细胞样品固定在载玻片或培养皿上,通过显微镜,由成像系统获取图像,定量分析细胞的形态学参数和细胞内一些生化成分的含量。常用仪器有显微分光光度计、图像分析系统和激光扫描共聚焦显微镜。流动式细胞分析要求将细胞样品悬浮在液体中,这些细胞悬液加入仪器后,高速度地流过仪器的检测区,仪器检测悬液中每一个细胞,并进行分析测定,记录每一个细胞众多的生物学参数,并可根据预选的条件将其中特殊的细胞亚群分选纯化出来,以供进一步的深入研究,这类仪器统称为流式细胞仪。以下对流式细胞分析技术、显微分光光度计和图像分析系统作简要介绍。激光扫描共聚焦显微镜已在显微镜技术一节介绍。
一、流式细胞分析技术
流式细胞仪(flow cytometer,FCM
)从原理上讲是一种在计算机技术支持下的高度自动化的细胞显微荧光脉冲分光光度仪,它是结合激光技术、光电测量技术、数字计算机技术和荧光细胞化学技术的产物,是分析细胞学领域的重要仪器。流式细胞术是一种对悬液中单个细胞或细胞器进行高速测量和自动分析的测量技术,每秒能测量数万个细胞并多参数检测,还能在分析的同时分选出有指定特征的细胞。
(一)流式细胞仪的结构与原理
流式细胞仪的一般结构可分为三个部分,细胞流动室和液流驱动系统;激发光源及其光束成形系统;细胞信号检测和分析系统。这三部分在仪器中一般按三个互为垂直的轴线安置,即X轴方向的激发光轴线、Y轴方向的细胞荧光信号检测轴线和
Z轴方向的细胞流轴线。此三个轴线的交点即为仪器的细胞信号检测区。样品中的每一个细胞必须按顺序依次以相同的速度和轨迹通过此检测区。每一细胞沿Z轴流经检测区时,受到激发光照射。细胞受光照时产生细胞的散射光信号与荧光信号,这些细胞信号由检测器收集,经计算机软件分析处理,这就是流式细胞分析。
流动室是流式细胞仪的核心部件,它采用液体动力学分层鞘流技术,层流技术保证样品中的每一细胞都沿流动室的中心轴运动,实现了每一细胞以相同的速度、相同方向、相同的轨迹逐个依次通过检测区,流动室也可称为单细胞流发生器。激光是一种单色性、方向性、相干性好的高强度光源,是细胞微弱荧光快速分析的理想光源。流式细胞仪的激发光源通常采用有多条可调谐的输出谱线的氩离子气体激光器,它能与多种荧光染料激发谱匹配。在实际应用时,一般采用单谱线488波长作为激发光源。检测器采用多通道光电倍增管,由数字显示器和示波器实时显示各种信号波形及数据参数,结果由计算机分析处理。
流式细胞仪分选装置一般由超声振动器、液滴充电电路、静电高压偏转场等组成。细胞分选是在细胞分析的基础上进行的,经确认需要分选的细胞,在该细胞到达液流断离端的即刻,由液滴充电电路发出一个充电脉冲,保证该包含有要分选细胞的液滴断离后带有静电荷。带电液滴向下运动经过高压偏转电场时,在静电力的作用下偏离原运动轨迹。带正电荷的液滴偏向负极,带负电荷的液滴偏向正极。静电高压值一般是固定的,调节充电脉冲幅度,改变液滴荷电多少,可改变充电液滴的偏转角和偏转距离。分选所得的细胞可以用玻片、试管、96孔板等进行收集,结合分选后的细胞培养、细胞形态学观察、细胞图像分析等结果,可以综合单个细胞的更多信息,这是其他细胞学技术难以实现的。
流式细胞仪中被测样品的细胞,流经仪器检测区时受到激发光的照射,激发光与细胞相互作用后可产生散射光信号和荧光信号。散射光信号是指激发光与细胞相遇作用后反射、折射、衍射等综合的结果,它能反映细胞群体及其不同亚群形态学的一些信息,并且不依赖细胞样品的荧光染色过程。荧光信号主要是指经过特异荧光染色后细胞受照发射的荧光信号。各种特异荧光染色方法是针对细胞内各种不同的生化成分或各种特异抗原等设计的。每一种荧光染色方法中必须用到一种或多种的荧光染料。由于每一种荧光分子结构不同,考虑荧光激发谱与荧光发射谱的接受时,通常要注意选择合适的激发光源和各类分束滤色片。流式细胞术为了保证获得准确的测试分析结果必须进行必要的质量控制,选用标准荧光微球和固定的鸡血细胞是最常用的仪器参考标准。
(二)流式细胞术样品制备
流式细胞术要做高精度的单细胞定量分析,对细胞样品的制备技术有着特殊的要求。一般包括单细胞悬液的制备和细胞荧光染色。
1.单细胞悬液的制备
流式细胞术的分析检测建立在单个细胞的基础上,制备合格的单个分散的细胞悬液是非常关键的一环。对不同来源和不同形式的样品,根据各种样品的特点可选择不同的分散方法。
(1) 单层培养细胞、血液、各种脱落细胞等样品,标本经过简单的制备悬液,离心分离处理,就可以得到分散较好的单个细胞悬液,是理想的流式细胞术检测对象。
(2) 对于不同组织来源的实体组织标本,采用酶消化法、机械法和化学试剂处理法来分散细胞。
(3) 石腊包埋组织单细胞悬液的制备,可使大量存档的临床资料重新得到研究与利用,从而扩大了流式细胞术的应用范围。样品制备一般通过切片、脱脂、水化、消化及终止消化后过滤再收集细胞悬液,去除碎片的单细胞悬液用70%酒精固定保存。