蛋白质凝胶染色法实验2
2. 总蛋白质荧光法染色
荧光染色法结合了检测灵敏度 (可与银染法媲美) 与染色流程简便性 (与考马斯亮蓝染 色 或 Z n 2+ 反染法相同),且其线性定量范围较比色法大 10〜100 倍 。检测依赖于仪器,需要一个单色激发光源、能将波长较长的发射光从波长较短 (也更亮)的激发光中分离出来的选择性光学滤镜以及一个检测模块。对于许多荧光染料,可通过目视检测,但是其灵
敏度不及采用摄像或仪器的方法。任何荧光染料都会带来一定程度的光漂白, 这是曝光的结果。许多市面上可购买的荧光染料已得到改进,光稳定性相对较好。尽管如此,在目测和图像采集前, 仍要小心避免将凝胶过久暴露于的外界强光之下。本章讨论的荧光染色法和染料的激发与发射的极限值在表 31.1 中呈列。通 常 ,光激发和发射的颜色经常以大类区分,即紫外线(U V )250 〜400n m ; 蓝 光 400〜500 n m ; 绿 光 500〜550 n m ; 黄光/橙 光 550〜580 n m ; 红 光 580〜650 m n ; 近红 外 线 650〜850 n m 。这也是下面讨论的目的。
荧光染料通常可分为两类: 在蛋白质条带部位表现出显著加强荧光效果的荧光染料和特异地结合蛋白质条带而不与凝胶基质结合的自发荧光染料。最早商品化的总蛋白质荧光染料,S Y P R O O r a n g e 和 S Y P R O R e d 凝 胶 染 料 于 1 9 世 纪 9 0 年代出现。这些染料最初是用于凝胶中染色 D N A 的常规荧光检测, 其检测方法是,先 经 300 n m 紫外线透射,随后进行宝利来一步摄影 (Polaroid photography)。开发上述商品化突光染料的目的是建立类似于溴化乙淀或 S Y B R Gre e n D N A 染色法一种简单的、一步式的总蛋白质特异染色和记录的工作流程,并且具有超越考马斯亮蓝染色方法的检测灵敏度。总蛋白质染料进一步的发展,产生了一些检测灵敏度范围近似于甚至超越了银染法的商业产品或配方。那些不需要在电泳前为样品加上共价标签的荧光凝胶染色法,与之后洗脱蛋白质条带的质谱分析相兼容。
尼罗红蛋白质凝胶染色剂
尼罗红 (Nile red) 是一种吩囉嗪酮类染料, 当其从水转入到疏水环境,如 S D S 微粒或蛋白质-S D S 复合物中时,便显示出强烈的荧光增强作用。尼 罗 红 不 会 与 S D S 单体发生显著作用》利用这一特点开发出了一种适合 S D S 凝胶的迅速的不用固定的总蛋白质染色法。该方案要求电泳在非标准条件下进行,即电泳缓冲液 S D S 含 量 为 0. 0 5 % (m /V ),要 低 于 去 污 剂 的 临 界 胶 束 浓 度 ,而 不 是 通 常 应 用 于 一 维 和 二 维 S D S -P A G E 的 0. 1 %(m/v ) 的 S D S 含量。蛋白质样品制备要符合规格 (Garn n ,1990a ;1990b ),如 此 S D S -蛋白质复合物在电泳时才会保持稳定, 蛋白质条带的迁移也被认为是正常的。这种方法简单快速: 将尼罗红储备液 (0.4 m g /m L 保 存 在 D M S O 中)在 水 中 稀 释 200 倍 ,至终浓度为2 ug/m L , 每块凝胶加人超过 1 0 倍胶体积的染液 (如 一 块 5 m L 的微型凝胶需要 50 m L染色液) 并立即充分搅动。染料在水中会快速地沉淀,故最理想的染色应该为 2〜5 m i n ,超过这个时间效果也不会增强。染色之后, 用水简单地清洗凝胶。可用紫外线或绿光光源激发, 蛋白质条带会出现淡红色。本法检测灵敏度与考马斯亮蓝染色法相似。因为没有 固 定 ,尼 罗 红 染 色 的 凝 胶 在 随 后 电 泳 印 迹 转 移 时 有 较 好 的 转 移 效 率( D a b a n ,2001;D a b a n et al.,1991)。染料的沉淀会在凝胶介质中形成高荧光背景,并 且 染 料 对 S D S 胶团的亲和性加上染料的不溶性使得该方法不能用于电泳缓冲液中含 0•1 % S D S 的 S D S ^P A G E 。染料的光稳定性也存在问题。
S Y P R O O r a n g e、S Y P R 〇 R e d 和 S Y P R O
Tangerine 蛋白质凝胶染色剂
S Y P R O R e d 和 S Y P R O O r a n g e 蛋白质凝胶染色剂是由 Steinberg 等 (1996a ;1996b )和 H a u g l a n d 等 (I” 7) 描述 的 ,S Y P R O T a n g e r m e 蛋 白 质 凝 胶 染 色 剂 是 由 Steinberg 等(2000b ) 和 Y u e 等 (2003) 描述的,所有这三种染色剂也同样经 Steinberg 等(2005) 讨论过 。这些染色剂含有一个亲水官能团、一个芳香族的荧光团及一个脂肪族尾部,使染料既具有良好的水溶性,又具有很强的插人蛋白质-S D S 复合物、S D S 微粒或膜的能力, 非极性环境下还有强烈的荧光增强作用。这些特征,再加上良好的化学和光学稳定性,可使染料以简便多样的染色步骤通用于标准缓冲液条件 (〇. 1 % S D S )S D S ——P A G E 后的染色,其检测敏感度超越了胶体考马斯亮蓝 0 2 5 0 染料。非标准缓冲液条件下 (0.05% S D S ) ,这些
染料与尼罗红相比染色敏感度可增加 4 倍, 但这对它们的使用不是必需的。
S Y P R O O r a n g e 和 S Y P R O R e d 为受ZL保护的磺丙基氨基氨基苯乙烯基( sulfopropylaminostyryl) 染料,在市面上可以买到,其规格为溶解于 D M S O 中 的 10 m m o l /L 储备液。染色方法很简单:① S D S - P A G E 后 ,将凝胶放在染色液里;②图像采集之前, 用水简单清洗凝胶。
制备染色液时, 在乙酸 [标准为 7 % ( V /V ),2 % 〜1 0 % 都有同样效果] 中将染料稀释5 000 倍 至 2 umol/L 。染色液通常需要现配,但也能稳定保存数月。电泳之后将凝胶放在凝胶体积 10〜2 0 倍 (一 块 5 m L 的微型凝胶对应 50〜100 m L ) 的染色液中,染色液放在聚丙烯或聚碳酸酯碟中并持续温和地搅拌。将装有凝胶的染色液碟置于紫外线灯箱或
蓝光透照仪中可定期监控染色情况, 还可以通过手持式紫外线灯或蓝光 L E D 监测染色情况 。通常对于 10 ug 的细胞裂解物,在荧光背景下 10 m i n 或 15 m i n 就可以看到大量蛋白质的荧光条带。随着染色过程进行,蛋白质条带信号增加,而背景减弱、丰度较小的蛋白质的条带也变得更明显。对 于 I m m 厚的凝胶,染色可以在 I h 内完成,且凝胶在染色液
中放置数日都是稳定的。蛋白质-S D S -染料复合物在稀释的乙酸中是稳定的, 但剩余的S D S 会从凝胶中扩散出来, 造成弱背景现象。因此应该最小限度地脱色。图像采集之前 ,需要用水清洗凝胶以移除凝胶表面的剩余染料、S D S 和乙酸,清洗时水需要更换两次 ,每次清洗需要 2〜3 m i n 。
S Y P R O T a n g e r i n e 蛋白质凝胶染料为一种受ZL保护的昨哩基乙稀基(carbazolylvinyl) 染 料 ,根据推荐的染料稀释液和预期用途,可 将 其 与 S Y P R O O r a n g e 和 S Y P R OR e d 蛋白质凝胶染色剂区分开来。这种蛋白质染料可在中性 p H 缓冲液 (50 m m o l /L 鱗酸盐、150 m m o l , ‘L N a C l ,p H 7. 0) 中使用,此时蛋白质条带不会被固定,而且随后可进行酶谱分析、洗脱、复 性 ,从而用于分析其离体活性或电转印迹。商业渠道获得的染料为10 m m o l /L 的 储 备 液 ; 染 色 液 由 此 稀 释 5000 倍 至 2 u m 〇 l/L , 现 用 现 配 。染色过程与S Y P R O O r a n g e 相 同 ,I h 内可完成; 图像采集之前用水清洗凝胶。利用紫外线光源或蓝光光源来完成光谱激发。
SYPRO R uby 蛋白质凝胶染色剂和其他基于钌的配方
诸 如 S Y P R O R u b y 蛋白质凝胶染色剂这样的用于检测凝胶中或印迹上的蛋白质的基于有机金属钌离子的发光染色剂,可以用简单的终点染色法步骤,提供与银染法相媲美 ,甚至超越银染法的荧光检测敏感度,还 被 引 入 S D S ——P A G E 后 (Berggren et al. ,2000)或等电聚焦电泳后 (Steinberg et al.2000a) 的即用型染色液配方中。这些染料的发展与配方是以胶体考马斯亮蓝染色方案为基础,其中的有机组分螯合发光的钌 (II) ,并且以同考马斯亮蓝染色法类似的方式为非共价蛋白质提供了基础,即首先与碱性氨基酸发生离子作用,其 次 再 发 生 疏 水 作 用 。(4,7-二 苯 基 -1, 10-菲 绕 啉 酯)钌 [ruthenium II tris
(bathophenanthroline disulfonate)] 制备、染 色 方 案 及 与 S Y P R O R u b y 蛋白质凝胶染色法的比较的详细说明告诉我们,S Y P R O R u b y 的染色原理与钌染色法很相似; 质谱分析反映出二者的一些微小差异,这些差异是由它们专有的化学性质引起的。随 后 S Y P R O
R u b y 凝胶染色剂得到改进,最初配方的性能得到提升, 成为了一种适用于 S D S ——P A G E 和等电聚焦凝胶的即用型染色液 (Berggren et al, ,2002)。因 此 S Y P R O R u b y 与钌染色法的不同之处不仅在于突光化学方面,更重要的在于染色液配方方面, 即其拥有稳定的即用
型染色液和相对简单的染色方案。
⑴ 用 5 0 % (V/V) 甲醇、1 0 % 0 VV ) 乙酸固定凝胶,固定时间为 30 min 至过夜。
(2) 凝 胶 用 S Y P R O R u b y 染 料 染 色 。这 是 一 种 终 点 染 色 法 ,染 色 3 h 至 过 夜 ,性质稳定。
(3) 用 10% 〇 //V ) 甲醇、7 % ( V /V ) 乙酸进行简单的凝胶脱色。
利用基于微波炉的方案可以加快染色过程的进行。 SYPRO R uby 蛋白质凝胶染料具有相对较高的消光系数和量子产率,因此它十分亮眼, 化学稳定性和光稳定性都很高。光谱的激发可借助紫外线或是蓝光光源; 蛋白质带目测呈橘红色。荧光蛋白质染色的机制在于该染料与蛋白质条带和凝胶介质结合的差异性, 凝胶介质不与染料结合。因此蛋白染色剂本身是不具荧光性的。 SYPRO R uby 蛋白质凝胶染料亮度大、稳定性高、检测灵敏度强且便于使用,加上其蛋白质组应用的文献之多以及积极的市场营销攻势,该产品
为其后蛋白质凝胶染色剂的发展提供了比较标准,正如银染法仍然是检测灵敏度的比较基准一样。
Epicocconone 蛋 白 质 凝 胶 染 色 剂 : Deep Purple 和 Lighting Fast 蛋白质凝胶染色剂
Epicocconone 蛋 白 质 凝 胶 染 色 剂 是 种 从 真 菌 黑 附 球 菌 (EpicoccMOT Tiignwn) 中提取的荧光团,用于总蛋白质染色试剂盒中。该染料被冠以了多种商品名称,包 括 DeepPurple 和 Lighting Fast 总蛋白质凝胶染料,方案各异。下面是一种方案。
(1) 将 SDS-PAGE凝 胶 在 7.5%(V/V) 的 乙 酸 中 固 定 1h。
(2) 用水清洗凝胶 (2X 30 m i n )。
(3) 荧光团储备液在水溶液中稀释后, 将凝胶在该水溶液中染色 I h。
⑷ 将 凝 胶 在 0. 05% (V /V ) 的氨水中孵育 (3X 10 m i n );
(5) 立即捕捉影像,可用紫外线、可见蓝光或可见绿光激发。
该染色剂的灵敏度可与 S Y P R O R u b y 蛋白质凝胶染料相媲美,或 者 较 之 更 好(Belland K a r u s o ,2003; Mackintosh etal. ,20 〇 3)。染色是可逆的,并与质谱分析兼容。暗红色的信号并非特别显著,其灵敏度完全取决于染色剂的荧光特性, 因此背景较弱。该染色方法似乎需要痕量的在乙酸固定后仍然与蛋白质形成复合物的 S D S 。 这种染色剂在水中仅发出微弱的荧光 (绿色),但 是 在 经 S D S 处理的蛋白质存在的情况下,荧光增强并发生红移 。 Epicocconone 蛋白质凝胶染料已被证实能与赖氨酸反应,形成可被碱水解的荧光加合 物 ,因此产生突光并使得染色具有可逆性 (Coghlan et al. ,2005)。浓缩的染色储备液必须冷冻保存,在使用前解冻。考虑到稳定性因素,影像捕捉应该在染色结束后立即进行。
荧光素衍生物
含有烃类尾部的荧光素衍生物是很有效的蛋白质凝胶染色剂。将 5-十二酰基氨基-(C 12-F L )、5-十六酰基氨基-(C 16-F L ) 及 5-十八酰基氨基-奕光素-(C 18-F L ) 用于一些类同于经典考马斯亮蓝 R -250 染色法的样品染色方案中,可证明该染色剂敏感度比得上银染法。最 有 效 的 荧 光 团 为 C 16-F L 。例 如 ,凝 胶 染 色 时 染 液 为 3 0 % (V /V ) 乙醇、7. 5 %(v/v) 乙 酸 、1umol/L 染料, 染液更换两次。再用水清洗,水也要更换两次,最 后 用 7.5%乙酸脱色。染色剂具焚光性,易知其基本原理是同结合在复合蛋白质中的残余 S D S 相结合; 可兼容质谱分析 ( K a n g et a L ,2003)。荧光素的光谱激发和发射分别由蓝光和绿光完成。
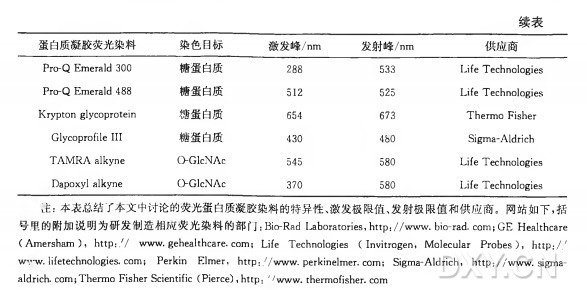
K r y p t o n 蛋白质凝胶染色剂
K r y p t o n 蛋白质凝胶染色剂是受ZL保护的轻基喹啉 (hydroxyquinoline) 类染料配方 ,激发光谱为绿色,突光显色为橙色 (Wolf et al. ,2007) 。 K r y p t o n Infrared 蛋白质凝胶
染色剂含受ZL保护的香豆素/氟喹诺酮和/或玛蒂娜 (Martina) 型染 料 , 激发光谱为红光/近红外线,发射光谱为近红外线 ( C z e m e y et al. ,2008)。可以买到这些产品的 10X 的组分 并 需 要 先 稀 释 成 可 用 的 溶 液 。这 些 产 品 在 检 测 灵 敏 度 和 动 态 线 性 范 围 方 面 同S Y P R O R u b y 和 D e 印 P u r p l e 蛋白质凝胶染色剂相当。染色方案依照标准的固定-染色-快速脱色的工作流程,并在快速染色方面得到改进, 因此整个染色过程可在 1〜4 h 完成;若要追求最高灵敏度和信号线性度, 可以延长此方案的时间。这些染色剂均可以和质谱分析兼容使用。
F l a m i n g o 蛋白质凝胶染色剂
Flamingo 蛋 白 质 凝胶染色剂是受ZL保护的基于香豆素的花青染料配方(Berkelm a n ,2006)。该染色方案需要在染色前完成固定。可以买到的染料为 I O X 的储备液,使用前用水稀释即可。当染料与蛋白质结合时表现出荧光增强作用。该染色剂背景较弱,报道称短脱色步骤可使背景进一步减弱。激发光谱在绿光范围内, 信号为橙色/红色。该染色剂被认为与银染和 S Y P R O R u b y 相当,并且也可以兼容质谱分析。
L U C Y 蛋白质凝胶染色剂
LUCY蛋白质凝胶染色剂是受ZL保护的三甲川花青(trimethinecyanine) 染料配方 , 在 S D S /蛋白质混合物中表现出荧光增强作用。染色通常在稀释的乙酸中进行,方法与 S Y P R O O r a n g e —样 。据报道该染色剂也能与质谱分析兼容 (Kovalska et al.,2006)。
3.预 电泳样品标记
琥珀醜亚胺酯是一种用于电泳前蛋白质样品的共价氨基标记的电荷平衡的花青染料(Cydye),它的研发和使用已成为荧光二维差异凝胶电泳(2- D D I G E ,—种非常重要的蛋白质组技术)的基础(M i n d e n et al. ,2002; T o n g e et al. ,2001; W a g g o n e r et aL ,1993)。D I G E 在 第 30 章中有更详细的讨论。有许多荧光复合物的琥珀酰亚胺酯以及其他能反应的荧光共价蛋白质标记物也同样被广泛使用(H a u g l and ,2005)s 如今拥有了广泛的仪器基础,对任何荧光标记的蛋白质制备物组分进行凝胶分析已是常规步骤。
磷 蛋 白 的 检 测
作为基本的细胞信号机制, 指定氨基酸残基的可逆磷酸化作用的重要性已无需争辩。当前磷蛋白染料具有受ZL保护的构型,即磷酸基结合部分共价连接于荧光团。检测的方式是选择性结合磷酸化的氨基酸,但是没有荧光增强作用。从某种程度上讲, 许多可溶的荧光复合物都可作为总蛋白质染色剂。一种选择性磷蛋白染料需要含有一个磷酸基结合部分、一个对总蛋白质的自发突光很低的荧光团 、 一 种可抑制非特异性总蛋白质染色的组分及一个促进残余的非特异染色解离的脱色方案。每个多肽中与总蛋白质染色剂靶定
的氨基酸数量相比,靶定的磷酸基仅有少数。磷蛋白检测敏感性通常和用胶体考马斯染色 剂 或 SYPRO O range 染 色 剂进行总蛋白质检测时处于同一水平,而不及银染剂或SYPRO Ruby 染色剂那么敏感。凝胶中蛋白质磷酸化检测需要有适当的对照,包括展示已知的磷酸化状态(阳性对照) 或去磷酸化状态(阴性对照)的蛋白质, 并且如果可以的话,还需有用活性憐酸酶对样品进行处理的对照。在检测到磷蛋白信号后,需要用一种总蛋白质染色剂对凝胶进行染色。市面上可以买到的磷蛋白染色剂可与随后的考马斯亮蓝染色剂、银染剂或总荧光染色剂 (如 SYPRO Ruby) 兼容, 但不能与依赖 SDS 的荧光染色剂(如 SYPRO Orange) 兼容。磷蛋白染料可与随后的分析步骤,如质谱分析或肽测序相兼容。
1.P r o - Q D i a m o n d 嶙蛋白凝胶染色剂
Pro-Q D i a m o n d 磷蛋白凝胶染色剂(Life Technologies) 系一种即用型配方,是根据磷酸肽 (p h o s p h o p 印 tide) 固定金属亲和层析的原理发明的,利用的是溶液中荧光团连接的金属螯合部分,这种溶液含金属离子、盐和可与水混溶的有机溶剂,用缓冲 液 调 p H 至4(A g n e W e tal.,2006)。这种染色方案需要在甲醇/乙酸溶液中固定,用水清洗以去除固定剂 ,用 P r o - Q D i a m o n d 配方进行染色,随后在含 1,2-丙二醇混合物中脱色,在乙腈中脱色效率更高 [如 50 m m o l /L 乙酸钠 (P H 4)、1 5 % 〜2 0 % 1,2-丙 二 醇 或 1 5 % 〜2 0 % 乙腈]。微型凝胶中的磷蛋白检测需至少 1〜2 n g 的丨酪蛋白(一种五磷酸化蛋白质) 或 8 n g 胃蛋白酶 (一种单憐酸化蛋白质),该检测法具有 1000 倍的线性动态检测范围。总蛋白质染色后,再 使 用 P r o - Q D i a m o n d 染色剂可得知蛋白质的体外磷酸化状态或去磷酸化状态。
2. Phos-t a g 磷蛋白染色剂
可以买到 P h o s -t a g 磷蛋白染色剂 (Perkin E l m e r) 的试剂盒包装, 其采用与 P r o - Q Dia m o n d 染色剂相同的通用染色策略,却有与之不同的缓冲液组分。 这些染色剂含有已有充分描述的 P h o s-t a g 结合部分,g 卩醇盐-桥的双核锌 (II) 配合物。该分子是根据可逆的磷酸锌 (II) 配合物的酶学原理设计的。解离常量为 25 n m o l /L 的 P h o s-t a g 苯基磷酸盐复合物与其他磷酸基结合部分的微摩尔解离常量的对比已有描述(Kinoshita et al. ,2004;K o i k e e t a L ,2007)。在某些情况下,Ph o s-t a g 技术对基于凝胶的磷蛋白分析比直接胶内憐蛋白染色更有效 (Kinoshita et al. ,2006; Y a m a d a et al. ,2007)。可买到的 Phos-tag 凝胶 染 色 剂 试 剂 盒 ,可 以 选 择 双 荧 光 ,最 大 激 发 光 谱 为 : P h o s-t a g 磷 蛋 白 凝 胶 染 色 剂300 n m /460 n m (双激发最大值) 或 540 n m 。近期报道称,使 用 Phos-tag 300/460 染色剂来检测一种具细菌性应答调节子的天冬氨酸磷酸化 (BarHeri and Stock,2008)。







