一例胰腺微囊型浆液性囊腺瘤病例分析
病例女,37岁。无明显诱因出现上腹钝痛.腹部CT示胰颈部低密度占位,大小约2.3 cm×2.1 cm×1.8 cm,边界欠清.增强动脉期、实质期均呈低强化,胰体尾部未见异常密度灶,胰管未见扩张(图1a,1b)。

图1a,1b 增强CT示胰颈部低密度肿块,动脉期(图1a),实质期(图1b)均呈低强化
CT诊断:黏液性囊腺瘤可能大,不排除癌症可能。实验室检查肿瘤标记物,CAl25升高(42.13U/mL,正常<35 U/mL),CA19—9、CEA和AFP阴性。来我院超声科进一步检查,常规超声示胰颈部高回声结节,边界欠清(图2a)。超声造影(Contrast ultrasonography,CEUS)示造影剂进入10 s时胰颈部结节边缘开始强化,动脉期早于周围胰腺呈高增强(图2b),内可见多发微小囊状无增强区,呈蜂窝状表现;实质期廓清缓慢仍呈高增强(图2c),大小约2.7 cm×2.4 cm×2.O cm。诊断微囊型浆液性囊腺瘤可能大。
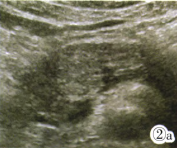
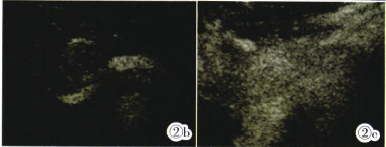
图2a-2c 图2a:超声示胰颈部高回声结节。图2b:CEUS示动脉期呈高增强,内见多发微小囊状无增强区。图2c:实质期强化部分廓清缓慢仍呈高增强。示囊壁由单层立方上皮衬覆,细胞胞浆透明。
临床诊断:胰颈部占位,性质待定,建议手术切除。术后病理:肿物切面灰黄、囊实性、质中,大小1.9 cm×1.8 cm×1.6 cm,界尚清,局部见紧邻包膜;光镜下囊壁由单层立方上皮衬覆,细胞胞浆透明(图3),诊断为胰腺浆液性囊腺瘤。
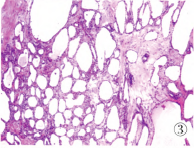
图3 镜下示囊壁由单层立方上皮衬覆,细胞胞浆透明
讨论
微囊型浆液性囊腺瘤(Serous micmcvstic adenomas of pancreases,SMA)是胰腺浆液性囊腺瘤最常见的亚型,一般为良性,由许多(≥6个)小囊或微囊(单个≤2 cm)组成。其典型增强影像表现为包膜及分隔强化呈蜂窝状,可有中央瘢痕及钙化。本病例增强CT对肿瘤内微小分隔显示欠佳,始终呈低强化,与胰腺癌难鉴别。而CEUS可灵敏显示细小分隔,与微小囊状无强化区对比显著呈蜂窝状改变,首先考虑为SMA。
由于胰腺囊实性肿瘤的多样性。影像学表现也较为多变及相互交叉,SMA的影像学表现易与分支型导管内乳头状黏液瘤、胰腺黏液性囊腺瘤及胰腺癌、胰腺神经内分泌瘤等实性肿瘤囊性变时相混淆。但不同组织学类型的囊实性肿瘤的治疗及预后有很大差别,具有恶性或潜在恶性生物学行为的肿瘤(如黏液性囊腺瘤、导管内乳头状瘤、神经内分泌瘤等),常需手术切除;而目前临床认为SMA患者无明显相关症状且瘤体小于3 cm时,可定期随访观察,使患者避免经受不必要的手术,因此SMA术前明确诊断至关重要。在观测胰腺微囊结构方面,CT稍逊于MR,但CT对钙化比较敏感。CEUS可实时动态连续观察病变的血流灌注情况,比常规超声能明显提高胰腺囊性病变诊断率。并且在显示胰腺囊实性肿瘤壁结节和分隔方面,准确性与MR无明显差异闭。因此,CEUS、MR和增强CT结合诊断,将极大程度上提高该病诊断的准确率。







