一例17-α羟化酶缺陷症病例分析(二)
知识回顾及病例分析
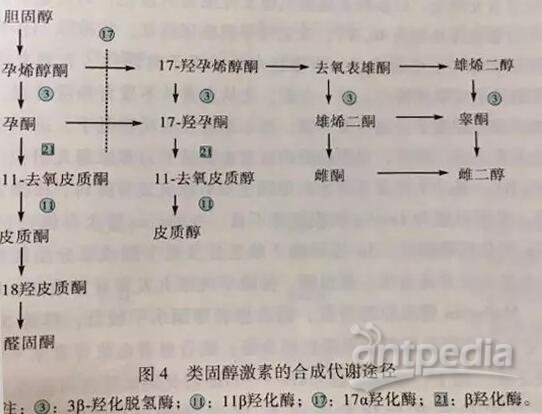
先天性肾上腺皮质增生症(Congenital adrenal hyperplasia,CAH)是一组常染色体隐性遗传性代谢疾病,其主要病理机制在于肾上腺皮质类固酮激素生物合成过程中某种代谢酶的先天性缺陷,引起肾上腺皮质激素合成不足,经下丘脑-垂体-肾上腺轴反馈调节,使促肾上腺皮质激素释放激素(corticotropin -releasing hormone,CRH)及促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)分泌增加(图4),导致肾上腺皮质增生及代谢紊乱。涉及CAH的代谢酶缺陷中,17α-羟化酶缺陷症属非常少见的类型,由XYP17A基因突变所致,可引起肾上腺皮质醇合成不足,反馈刺激ACTH分泌增加,使肾上腺盐皮质激素合成增加[皮质酮和脱氧皮质酮(DOC)],可达正常的30~60倍。本病患者一般没有肾上腺皮质功能减退表现,这是由于该酶缺陷时皮质酮分泌大量增加,而皮质酮本身具有一定程度的糖皮质激素活性。由于皮质醇和性激素合成受阻,而DOC和皮质酮分泌增多,导致临床主要表现为高血压、低血钾、碱中毒及性发育缺陷,女性患者表现为性幼稚、青春期缺乏第二性征发育和原发性闭经,男性表现为假两性畸形,外生殖器酷似女孩,但无子宫和卵巢,阴道呈盲端,可伴隐睾,内生殖器亦发育不良。
该患者因原发性闭经、高血压、低血钾入院。一方面,先从低血钾的角度入手,首先患者明确合并高尿钾,提示肾性失钾,结合患者血压升高,进一步行卧、立位试验检查肾素水平和醛固酮水平,试验结果提示患者肾素水平受抑制,醛固酮水平不高,综上主要考虑Liddle综合征及CAH:Liddle综合征十分罕见,多有明确家族史,且为低肾素活性,同时醛固酮水平低,患者家族史阴性,醛固酮水平不低,不考虑此病;患者存在性发育异常,影像学检查提示双侧肾上腺增粗,故考虑CAH可能性大,临床表现为高血压、低血钾、高尿钾的CAH主要有17α-羟化酶缺陷症和11β-羟化酶缺陷症,而17-α羟化酶缺陷症女性患者性不发育,男性患者女性化;11β-羟化酶缺陷症女性患者男性化,男性患者性早熟。此患者多次查染色体核型为46,XY,未见性早熟临床体征,故排除11β-羟化酶缺陷症;查体见女性外生殖器表型,腹部超声提示无子宫附件、有睾丸组织,符合17α-羟化酶缺陷症临床特点。另一方面,先从患者性不发育角度考虑,患者性腺激素检查示促性腺激素分泌显著升高,提示患者性腺功能低下,进一步行影像学检查示先天无子宫、卵巢,双侧腹股沟区富血供结节,考虑睾丸组织,查染色体核型为46,XY。46,XY性发育异常的原因主要有睾丸发育障碍、雄激素合成与作用障碍等,考虑可能为Leydig细胞发育不良、Mullerian管永存综合征、StAR缺乏症、17α-羟化酶缺陷症、5α-还原酶2缺乏症及完全型或部分型雄激素抵抗综合征,结合患者合并高血压、低血钾,排除单纯睾丸发育异常致病、Leydig细胞发育不良、Mullerian管永存综合征;结合患者睾丸水平较低,排除5α-还原酶2缺乏症及完全型或部分型雄激素抵抗综合征;结合患者血浆肾素水平受抑制,排除StAR缺乏症。综上,临床考虑CAH——17α-羟化酶缺陷症可能性大。
17α-羟化酶缺陷症生化检查可见17-羟孕酮(17-OHP)、去氢表雄酮(DHEA)、雄烯二酮、睾酮、皮质醇水平低下,孕酮、DOC、皮质酮水平升高,血钾(K)因皮质酮储钠排钾作用呈顽固性降低,血浆肾素活性(PRA)也因此受到抑制。该患者符合上述17α-羟化酶缺乏症生化表现。应用ACTH兴奋试验,以外源性ACTH兴奋肾上腺皮质,监测血浆皮质醇、尿17-羟皮质类固醇(17-OHCS)、17-酮类固醇(17-KS)变化,评价肾上腺功能,可明确诊断。但因ACTH试剂临床上较难获得,该试验实际操作受限。部分患者需经基因检测,方可明确诊断。
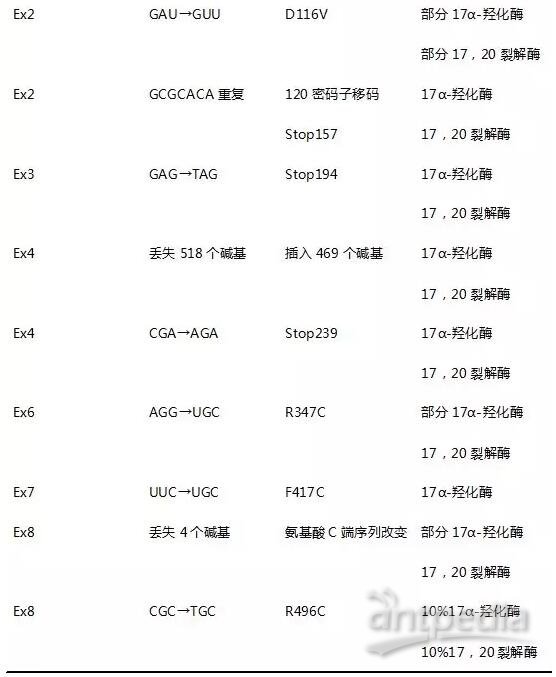
17α-羟化酶(CYP17A)定位于10q24.3,包含8个外显子。CYP17A基因突变是引起17α-羟化酶活性部分或全部丧失的分子病理基础。目前已报道出相关基因突变多在第1、2、4、8号外显子上(表5),患者经基因检测结果提示在CYP17A基因第1、7、8号外显子均存在突变位点,17α-羟化酶缺陷症诊断明确。当然,也有病例报道指出有17α-羟化酶缺陷症患者未检测出CYP17A1基因突变,机制尚未明确。
表5 CYP17A基因缺陷类型

针对17α-羟化酶缺陷症,最主要的治疗是激素替代治疗,包括糖皮质激素和性激素。糖皮质激素替代治疗的目的在于补充肾上腺皮质醇分泌的不足,抑制ACTH的过量分泌,减少DOC等物质的分泌,使血压下降并纠正低血钾。该患者行中剂量地塞米松抑制试验,ACTH可抑制至1.1
pmol/L以下,反映良好,遂予地塞米松治疗。适量的雌激素可增加骨骼的钙盐沉积、加速骨骺闭合,增加骨量,减少骨丢失。该患者已至中年,应补充雌激素维持其社会性别,还有利于改善其骨质疏松。
此类患者另一个亟待解决的问题是其腹部超声提示有睾丸组织,为防止睾丸组织恶变,行外科手术切除双侧隐睾。术后一个月我科复诊时,血压控制情况良好,查血钾正常,也从侧面印证17α-羟化酶缺陷症的诊断。后患者门诊复诊逐渐调整药物剂量至个体生理所需最小量,长期维持。
专家点评
先天性肾上腺皮质增生症(CAH)因发病率低、临床认识不足、检查手段受限、确诊有赖于基因测序等原因,诊断较困难。而17α-羟化酶缺陷症作为CAH的少见类型,明确诊断者甚少。
对于17α-羟化酶缺陷症,因酶活性的缺陷程度不同,造成临床表现有很大的差异。完全型17α-羟化酶缺乏症:患者表现为青春期发病,孕酮、DOC等盐皮质激素堆积,皮质醇、性激素合成障碍,ACTH代偿性分泌增加,使肾上腺皮质增生,进一步加重DOC、皮质酮堆积,从而引起血压升高、血钾降低、血肾素活性降低、性激素合成障碍在46,XX患者可表现为乳房及性毛不发育、原发闭经;46,XY患者则因睾酮合成障碍,致使外生殖器呈女性幼稚型,无子宫输卵管,阴道呈盲端,患者为女性表型,腹腔或腹股沟内有发育不良的睾丸。实验室检查可见血LH、FSH、孕酮水平升高,雌二醇、睾丸、17-OH孕酮水平低下,身材较高,骨龄滞后。不完全型17α-羟化酶缺陷症:与完全型17α羟化酶缺陷症的不同点主要是患者可有不同程度的乳房发育,还可表现为血压不高或血钾水平不低,46,XX患者可有月经稀发或继发闭经,余临床表现类似。
治疗上主要是糖皮质激素替代治疗。目前治疗尚无统一标准,我科的经验是先予醋酸地塞米松0.75
mg,1次/睡前,监测ACTH变化,观察高血压、低血钾纠正情况,及时调整药物及剂量。地塞米松开始治疗时仍需给予降压及补钾治疗,根据疗效决定停药时机,通常情况下,患者低血钾的症状会在补充地塞米松1~2周后得到纠正,而高血压症状的缓解情况则与其病程长短密切相关,若患者血压升高时间较长,已造成动脉硬化,治疗后血压可能无法完全恢复正常,仍需辅以降压药物治疗。需注意的是该类患者的肾素-血管紧张素-醛固酮系统长期处于抑制状态,故在过度利尿、排钠、保钾的作用下,应考虑到患者可能出现低血压、低血钠、高血钾等情况。治疗的另一方面在于合理的性别选择及维持。对于17α-羟化酶缺陷症患者,不论染色体核型如何,仍建议大部分患者维持女性的社会性别,外科手术治疗主要应用于染色体核型为46,XY患者,一方面该类患者常伴隐睾,目前研究已证实发育不良及隐睾发生肿瘤的危险比正常人高1~10倍,最好的治疗方法是进行外科手术切除;另一方面17α-羟化酶缺陷症男性假两性畸形患者阴道常呈盲端,一般不超过5
cm,影响生活质量,需行阴道扩张术。此外,性激素替代治疗也是十分重要,除促进患者第二性征发育、维持患者社会性别,于性激素替代治疗还可改善脂代谢、骨代谢水平。此类患者一经诊断,多易合并心理问题,还应注意对其进行心理评估及治疗。建议对于该类患者应长期随访。




















