一例患者胰腺肿物4年,间断上腹痛2年误诊病例分析
病例资料:
男,70岁。因发现胰腺肿物4年,间断上腹痛2年,再发2d入院。4年前健康体检时行超声检查发现胰头勾突部实性占位性病变入住我院干部病房, 无腹痛、腹泻,无恶心、呕吐,无黄疸、发热。有糖尿病病史14年,无高血压病、冠心病及家族遗传病史。无肝炎及结核等传染病史。无吸烟、酗酒史。
查体:体温36.4℃;脉搏78/min,呼吸20/min,血压120/76mmHg。意识清楚,精神可。皮肤、巩膜无黄染。浅表淋巴结未触及增大。心肺检查未发现异常。腹平软,全腹无压痛、反跳痛、肌紧张,Murphy征(-),肝脾叩击痛(-),移动性浊音(-),肠鸣音正常。双下肢无水肿。肝功能、肿瘤标志物[癌胚抗原(CEA)、癌抗原(CA)199、CA724、CA125等]及血淀粉酶、脂肪酶检查未见异常,红细胞沉降率42mm/h。
胰腺超声检查示胰头勾突部实性占位性病变(4.8cm×3.0cm×2.6cm)、主胰管轻度扩张(0.39cm)、胆囊多发结石。
胰腺增强CT检查示胰头明显增大,胰管扩张,增强呈均匀强化,见图1;正电子发射计算机断层显像(positron emission tomography-computed tomography,PET-CT)检查示胰头病变,葡萄糖代谢不均匀轻度增高,考虑假瘤性胰腺炎,恶性病变(胰头癌)待除外。于超声内镜引导下胰腺穿刺检查示胰头部低回声区,内部回声均匀,胰体部胰管仅轻度扩张、胆总管轻度扩张;病理超薄细胞涂片检查示纤维素性渗出和黏液性背景中查见胰腺导管上皮细胞、纤维细胞及小灶成团排列的轻度异型细胞,不除外为肿瘤细胞,见图2。
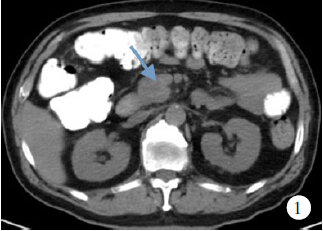
图1自身免疫性胰腺炎患者4年前胰腺增强CT检查结果(箭头所指为胰腺肿物)
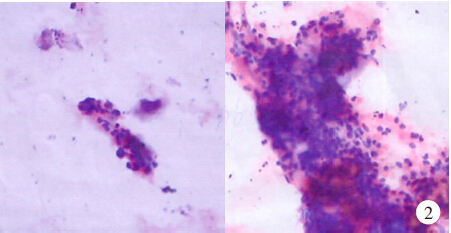
图2自身免疫性胰腺炎患者4年前超声内镜引导下胰腺穿刺活组织病理检查结果(HE×40)
胰腺核医学检查示上腹部(胰头区)放射性摄取稍增高灶,不除外神经内分泌肿瘤可能。内科诊断胰腺肿瘤(性质未特指),未予特殊治疗;肝胆外科医师会诊考虑胰腺神经内分泌肿瘤,暂无手术指征,建议门诊随访。
2年前患者因突发右上腹疼痛入院。查体:体温36.6℃;脉搏82/min,呼吸20/min,血压130/78mmHg。皮肤、巩膜无黄染。浅表淋巴结无增大。心肺检查无异常。腹平软,全腹无压痛、反跳痛、肌紧张,Murphy征(+),肝脾叩击痛(-),移动性浊音(-),肠鸣音正常。双下肢无水肿。查血淀粉酶及脂肪酶正常,白细胞8.35×109/L,中性粒细胞0.80,直接胆红素13.9μmol/L,总胆红素26.2 μmol/L,丙氨酸转氨酶55U/L,天冬氨酸转氨酶109U/L,谷氨酰转肽酶98.4U/L,CA19-9 37.7U/ml,CEA 4.8μg/L、IgG4 6.70g/L,抗核抗体效价1:1000,抗核抗体谱示抗着丝点B抗体(+)。
腹部超声检查示胆囊增大伴大量泥沙样结石,胆总管轻度扩张,胰头区实性包块。诊断胆石症伴急性胆系感染、胰头占位,自身免疫性胰腺炎不除外,予抗感染、退黄及保肝等药物治疗,症状消失,血常规及胆红素恢复正常。针对胰腺肿物建议试验性糖皮质激素治疗但患者拒绝。于入院后52d转入肝胆外科行胆囊切除术,手术顺利,无胆漏及切口感染等并发症,术后10d痊愈出院。肝胆外科出院诊断胆石症伴胆囊炎,肿块型胰腺炎。
2d前患者再次出现上腹痛入院。急查肝功能及血清淀粉酶、脂肪酶均正常。查体:体温36.6℃,血压130/70mmHg。心肺检查未发现异常。腹部稍膨隆,剑突下轻压痛,无反跳痛、肌紧张,Murphy征(-),肝脾区叩击痛(-),肠鸣音正常。抗核抗体初筛(突光法)1:1000,抗核抗体谱示抗着丝点B抗体(+),红细胞沉降率68mm/h,C反应蛋白3mg/L,免疫球蛋白、补体C3、补体C4、抗链球菌溶血素O及类风湿因子检查正常,IgG4 1.47g/L。
超声检查示胰头低回声实性占位(较前无明显变化)并主胰管内径增宽。胰腺增强MRI检查示胰头丰满,胰体尾部较前稍萎缩。拟诊AIP。经反复告知病情并解除患者对糖皮质激素药物的顾虑及误解后,于入院后25d开始给予甲泼尼龙32mg,每日晨1次口服试验性治疗。
治疗期间血糖稍有波动,给予胰岛素治疗,血糖控制可。治疗1个月后复查抗核抗体初筛(荧光法)1:320,抗核抗体谱示抗着丝点B抗体(+),CA19-9 21.4U/ml、CEA 3.8μg/L,红细胞沉降率、C反应蛋白、免疫球蛋白、补体C3及补体C4检查正常。复查胰腺增强CT示胰头异常强化,与前次检查比较变小,胰头占位病变3.1cm×2.0cm×1.4cm,胰管无扩张,见图3。确诊AIP,出院。出院后随访9个月,一般情况良好,无复发。
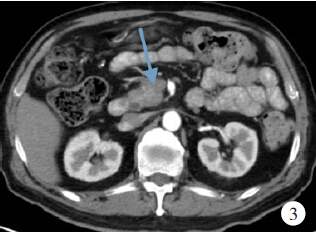
图3自身免疫性胰腺炎患者予糖皮质激素治疗1个月后胰腺增强CT检查结果(箭头所指为胰腺肿物)
讨论
疾病概述 AIP是一种由自身免疫介导的特殊类型胰腺炎,我国目前无明确流行病学统计数据,日本的调查研究报道AIP年发病率为0.9/10万,多见于男性。AIP临床以梗阻性黄疸、腹部不适为主要表现,组织学表现以淋巴细胞、浆细胞浸润并伴胰腺纤维化、功能障碍为主,并可累及胆管、涎腺、肾及肺等胰腺外器官。因该病临床症状、血清学及影像学检查同胰腺癌、恶性淋巴瘤等疾病类似,经常被误诊而采取不必要的手术治疗。AIP糖皮质激素治疗敏感。
诊治分析
本例4年前健康体检发现胰腺肿物,早期无任何临床症状,进行多种实验室及影像学等检查均未能明确诊断,胰腺穿刺活组织病理超薄细胞涂片示纤维素性渗出和黏液性背景中查见胰腺导管上皮细胞、纤维细胞及小灶成团排列的轻度异型细胞,不除外为肿瘤细胞;2年前开始逐渐出现间断上腹痛、黄疸,经相关检查考虑胆石症伴急性胆系感染,给予抗感染、退黄及护肝治疗后好转,查IgG4
6.70g/L,抗核抗体效价1:1000,抗核抗体谱示抗着丝点B抗体阳性,曾考虑AIP,但因患者忌讳糖皮质激素不良反应未接受治疗,因患者多次发作上腹痛、黄疸遂行胆囊切除术治疗,但术后仍有上腹痛发作。2d前患者再次出现上腹痛入院,行相关医技检查较前无明显变化,给予试验性糖皮质激素治疗,胰腺肿物较前明显缩小,确诊AIP。
诊断措施 AIP临床表现包括波动性黄疸、部位模糊的上腹部疼痛、背痛、体重减轻、易疲劳、糖尿病或者完全没有临床症状,常有皮肤、巩膜黄染,部分有上腹压痛以及胰腺外器官受累的相应体征。AIP可伴胰腺外器官受累,1型AIP常伴发硬化性胆管炎、类干燥综合征、硬化性涎腺炎、肺门淋巴结增大、间质性肺炎、腹膜后纤维化及间质性肾炎等;2型AIP可合并炎症性肠病。本例反复出现腹痛,由于临床医生对该病认识不足,早期仅考虑为胆石症伴胆系感染,未考虑到可能合并AIP或根本就是AIP胰腺外器官受累导致黄疸、腹痛的反复。
1型AIP特征性血清学标志物是IgG4水平,IgG4≥1.35g/L为诊断AIP的一个重要指标。此外,其血清学诊断指标还包括高γ球蛋白血症、红细胞沉降率增快、IgG升高、抗核抗体及类风湿因子阳性及CA19-9异常等。2型AIP血清IgG4水平一般不升高,自身免疫抗体多为阴性。但是,IgG4在部分胰腺癌患者中亦有表达(约10%);CA19-9>100U/ml时AIP的可能性只有18%,而胰腺癌的可能性高达80%。最近一项研究发现将血清学IgG4水平以1.35g/L为临界值,诊断AIP的敏感性和特异性分别为92%和98%。本例2次行IgG4检测数值均高于1.35g/L,有助于临床诊断AIP。
AIP影像学表现为胰腺弥漫性增大,少数为局灶性增大。胰腺受累部位在超声及内镜超声上呈低回声,胰周可伴有低回声包膜样边缘;CT检查呈低密度,伴有低密度的包膜样边缘(“腊肠样”改变);MR T2加权像上呈轻度高信号、T1加权像上呈低信号;增强CT和增强MR上表现为动脉期增强减低,延迟期轻度强化。马晓璇等研究发现CT灌注成像可量化评价AIP的血流动力学改变,对2型AIP的诊断与鉴别诊断有重要价值;丁玖乐等认为增强CT与磁共振胰胆管成像(magnetic resonance cholangiography,MRCP)对局灶型AIP与小胰腺癌鉴别诊断价值有限。AIP内镜下逆行性胰胆管造影术(endoscopic retrograde pancreatic angiography,ERCP)的典型征象为胰管纤细和狭窄(>1/3全长)、狭窄胰管近端无显著扩张(<5mm)、胰管可呈多处狭窄、狭窄段可见分支胰管等,部分患者可见胆管狭窄,或有硬化性胆管炎表现;MRCP对胰管成像的准确性低于ERCP。PET-CT可全身扫描,AIP特征性征象为胰腺弥漫性摄取增高,部分患者合并涎腺、下颌下腺及肾脏等胰腺外摄取增高病灶。本例先后多次完善胰腺增强CT、胰腺增强MRI及PET-CT等检查,未发现典型影像学改变,这是导致临床医生延误诊断的重要原因。
内镜超声引导下细针穿刺活组织病理检查、Trucut针穿刺细胞学检查有助于AIP的组织病理学诊断。AIP病理学表现为胰管周围淋巴细胞、浆细胞浸润和胰腺间质炎性改变。根据全球调查,AIP可分为2个亚型,1型AIP病理学表现为淋巴浆细胞硬化性胰腺炎(lymphoplasmacytic sclerosing pancreatitis,LPSP),典型病理所见为胰腺导管周围淋巴细胞、浆细胞明显浸润,实质呈席纹状纤维化,闭塞性静脉炎和大量IgG4阳性细胞(每高倍视野>10个),1型AIP合并的胰腺外受累脏器也可有类似的病理学所见,为IgG4相关疾病在胰腺的局部表现,但尚不明确IgG4在AIP发病机制中是处于中心地位还是仅为一种表象;2型AIP病理学表现为特发性导管中心性胰腺炎(idiopathic ductcentric pancreatitis,IDCP),2型AIP典型病理所见为胰腺导管周围有大量中性粒细胞浸润并导致导管上皮损害(granulocyte epithelial lesion,GEL),一般不伴有血管旁炎症,IgG4阳性细胞少见,2型AIP较少在亚洲发现,发病年龄低于1型AIP,IgG4血清学检测多为阴性,目前认为与粒细胞上皮病变及炎症性肠病相关。本例胰腺穿刺病理检查结果相对符合1型AIP,但不典型。
国际上AIP的诊断标准主要是通过胰腺影像学检查、血液检查、胰腺外器官受累情况、胰腺病理学和糖皮质激素治疗效果等方面来确定,大多数诊断标准的项目都是类似的。2012年我国AIP诊治指南(草案)提出的诊断标准:A组,符合1型或2型的胰腺组织病理学;B组,典型影像学征象、血清IgG4水平升高或典型胰腺外器官受累表现;C组,非典型的影像学征象、血清IgG4水平升高和(或)其他脏器中出现lgG4阳性细胞、除外胰腺肿瘤、糖皮质激素治疗效果显著。但是,不同国家、地区的AIP诊断方法仍有部分不同,如在日本ERCP是AIP诊断必须完善的检查,而美国梅奥诊所规定胰腺活组织病理检查是AIP诊断所必不可少的。
治疗方法 目前糖皮质激素仍是AIP的首选治疗手段。糖皮质激素治疗的初始剂量以泼尼松为例一般为每日0.6mg/kg,每1~2周减5mg,直至维持剂量每日2.5~5.0mg/kg。临床上多数AIP患者在接受糖皮质激素治疗1个月后临床症状缓解,血清学及胰腺影像学检查改善。若糖皮质激素治疗效果不佳,首先需考虑疾病的诊断正确与否,再考虑联用或换用免疫抑制剂、利妥昔单抗等药物。国内有学者研究认为如果AIP患者糖皮质激素治疗无效,则应高度怀疑胰腺癌可能。一般AIP患者不建议采取手术治疗,当临床难以除外恶性肿瘤时方考虑手术。本例此次入院后初步考虑AIP,通过积极与患者沟通,给予试验性糖皮质激素治疗1个月,胰腺肿物较前明显缩小,确诊AIP。该患者治疗期间血糖稍有波动,给予胰岛素治疗,血糖控制可,无其他并发症出现。
误诊原因分析及防范措施 首先,AIP临床发病率低,虽近年报道逐渐增多,但多数临床医生对该病认识不足,诊断思维局限,遇及类似患者常首先考虑临床常见病、多发病,易导致误诊、误治。本例首次就诊接诊医生诊断思维局限,仅根据穿刺病理检查见到轻度异型增生细胞,考虑良性肿瘤;后患者反复多次出现腹痛就诊,接诊医师仅考虑胆石症及急性胆囊炎等临床常见病,忽视胰头增大导致腹痛可能,2年前患者入院时根据各项指标已可确诊AIP,但因医生对该病认识不足,只是给予AIP可能性大的诊断。其次,未能充分与患者沟通、交流是导致本例误诊的另一个原因。希波克拉底说“医生有三宝,语言、药物和手术刀”,一个不能有效地与患者沟通、交流的医生,其医疗结果将是难以预测的。本例2年前入院时,经相关检查曾考虑AIP,但因接诊医师与患者沟通不够,未能进行试验性糖皮质激素治疗,从而再次错失确诊机会。此外,本例2年前住院时在转诊到肝胆外科时未能做到无缝衔接,患者未能接受连续性医疗,已考虑AIP的患者,转诊到其他科室后却给出肿块型胰腺炎诊断,这也是导致本例延误诊断的另一个原因。
本例提示临床医生应加强学习,提高对AIP的认识,熟悉该病的诊断,避免陷于诊断误区,同时要加强与患者及其家属的沟通交流,向患者说明药物对治疗的作用及可能出现的不良反应,强调并详细说明相关药物治疗的必要性,提高治疗依从性,转诊过程中要详细告知患者病情,并与相关科室医生做好交接工作,以避免漏误诊。临床遇及不明原因上腹部疼痛,影像学检查提示胰腺占位性病变患者时,除考虑胰腺恶性肿瘤外,还应高度警惕是否存在AIP,应进一步行相关实验室检查,尤其是IgG4检测,必要时行超声内镜下活组织病理检查并综合分析病情,以防误诊、误治,延误诊断和治疗。