药物检测技术--片剂质量差异检查法
质量差异系指按规定称量方法测得片剂每片的质量与平均片重之间的差异程度。在片剂生产过程中,由于颗粒的均匀度、流动性以及工艺、生产设备和管理等原因,都会引起片剂质量差异。片剂质量差异会引起各片间主药含量的差异,从而影响用药剂量。因此,为保证用药剂量的准确,必须按规定对片剂质量差异进行严格控制。
凡规定检查含量均匀度的片剂,一般不再进行质量差异检查。
一、引用标准
《中国药典》(2010版)二部附录I A。
二、仪器与用具
(1)分析天平 感量0.1mg(适用于平均片重0.30g以下的片剂)或感量1mg(适用于平均片重0.30g或0.30g以上的片剂)。
(2)扁形称量瓶。
(3)弯头或平头手术镊。
三、操作方法
(1)取空称量瓶,精密称定质量;再取供试品20片,置此称量瓶中,精密称定。两次称量值之差即为20片供试品总质量,除以20,得平均片重。
(2)从已称定总质量的20片供试品中,依次用镊子取出1片,分别精密称定质量,得各片质量(凡无含量测定的片剂,每片质量应与标示片重相比较)。
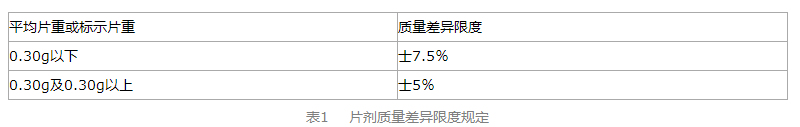
四、片剂质量差异限度规定
片剂质量差异限度规定见表1。
五、记录与计算
(1)记录分析天平的型号,记录称量室的温度与湿度。
(2)记录20片的总质量,记录每片的质量。
(3)计算平均片重,保留三位有效数字。
(4)记录20片的平均片重,根据平均片重和质量差异限度规定计算出允许差异的限度范围。
(5)计算超出限度范围的片数及超出数据。遇有超出允许片重范围并处于边缘者,应再与平均片重相比较,计算出该片质量差异的百分率,再根据表1规定的质量差导限度作为判定依据(避免在计算允许装量范围时受数值修约的影响)。
六、结果与判定
(1)20片中每片质量均未超出允许片重范围;或与平均片重相比较(凡无含量测定的片剂,每片质量应与标示片重相比较),均未超出表1中的质量差异限度;或超出质量差异限度的药片不多于2片,且均未超出限度1倍。以上均判为“符合规定”。
(2)每片质量与平均片重相比较,20片中超出质量差异限度的药片多于2片,判为不符合规定。
(3)20片中超出质量差异限度的药片虽不多于2片,但其中1片超出限度的1倍,判为“不符合规定”。
七、注意事项
(1)在称量前后,均应仔细查对药片数;称量过程中,应避免用手直接接触供试品;已取出的药片,不得再放回供试品原包装容器内。
(2)遇有检出超出质量差异限度的药片,宜另器保存,供必要时复核用。
(3)糖衣片的片芯应检查质量差异并符合规定,包糖衣后不再检查质量差异。
(4)薄膜衣片应在包薄膜衣后检查质量差异并符合规定。
(5)《中国药典》(2010版)二部附录规定,进行质量差异检查的剂型主要有片剂、栓剂、丸剂和膜剂,测定方法基本相似,主要区别在于所取供试品数量及质量差异限度不同,见表2。