一例癌症相关性视网膜病变病例分析
患者,男,64岁。因双眼视力下降3个月余,伴双眼闪光感、眼胀、视物模糊、周边视物不清及暗光、强光下视力下降来我院眼科就诊。发病前1个月曾在当地医院行右耳前黑痣切除手术,手术后病理检查结果提示为基底细胞癌、切缘千净。手术后未行放射、化学药物治疗。
我院眼科检查:双眼最佳矫正视力均为0.8。玻璃体未见细胞。双眼视盘颜色略淡,边界清楚。动脉血管略细。视网膜可见轻微斑驳样色素紊乱,未见骨细胞样色素沉着(图1)。蓝光眼底自身荧光成像( FAF)检查发现,黄斑外自身荧光弥漫增强(图2)。荧光素眼底血管造影(FFA)检查发现,双眼视网膜弥漫斑驳状透见荧光,视网膜静脉节段性血管壁着染、轻微荧光渗漏(图3)。吲哚青绿血管造影检查未见异常。双眼视野呈管状(图4)。
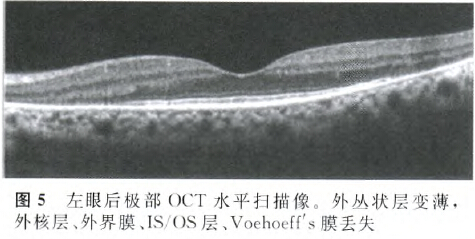
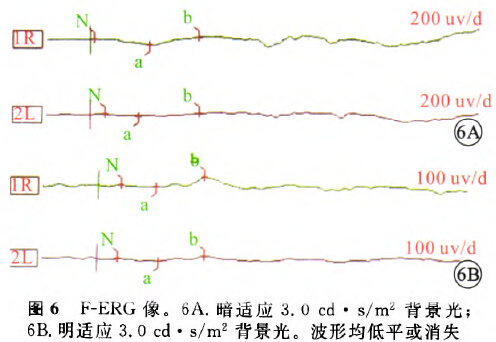
光相干断层扫描(OCT)检查发现,外丛状层、外核层、外界膜、光感受器内外节连接(IS/OS)层、Voehoeff's膜等视网膜外层变薄或丢失,黄斑区外明显(图5)。闪光视网膜电图( F-ERG)检查发现,在暗适应1.0、3.0、30.0 cd·s/m2背景光下,各反应波形均低平或消失(图6)。颈部B型超声检查发现,双侧颈部多发肿大淋巴结。颅脑、眼眶核磁共振成像检查平扫加增强均未见异常。

1个月后复查,患者自觉颜面部瘙痒。双眼视力均下降至0.6。眼底病变无明显改变。副肿瘤综合征抗体检测结果显示,抗神经元核抗体I型、抗蒲肯野细胞抗体、抗神经元骨架蛋白抗体等抗神经元细胞核抗体自身抗体均为阴性;抗Ma2蛋白抗体、抗CRMP5蛋白抗体、抗神经元突触囊泡抗体均为阴性。诊断:双眼癌症相关性视网膜病变(CAR)。
讨论
CAR是指非原发肿瘤的占位压迫或肿瘤转移所致的一种视网膜变性疾病,为机体癌症的远部效应,是眼部副肿瘤综合征(PNS)较为常见的一种类型。CAR临床较为少见,无明显性别差异,引起CAR的恶性肿瘤最常见的为小细胞肺癌,其次为生殖系统肿瘤和乳腺癌,其他各种肿瘤也可引起。但像本例患者这样由皮肤基底细胞癌导致的较为罕见。
CAR的发病机制可能是由于肿瘤抗原诱导产生的抗体与正常的视网膜组织抗原发生交叉免疫反应,从而造成视网膜正常组织的损伤,其中最重要的自身抗体是抗恢复蛋白(recoverin)抗体,而该蛋白特异性的存在于光感受器细胞和双极细胞中。因此,CAR以进行性视力下降、闪光感、视野环形暗点等为主要表现。且CAR多为亚急性双眼无痛性视力丧失,约50%的患者视网膜病变在其原发恶性肿瘤确诊前3~12个月发病或被发现。CAR早期眼底表现多正常,随病程延长可逐渐出现视网膜小动脉变细,视网膜色素上皮(RPE)层变薄,眼底呈斑驳状改变,数个月后可以出现视盘变白,偶可见葡萄膜炎、视网膜血管炎、视网膜静脉周围炎等。
FFA检查可见RPE层变薄区域呈斑驳状透见荧光,伴有视网膜血管炎者可有血管壁和视网膜组织的着染。FAF检查可见RPE功能受损的状态。OCT检查可见视网膜外层的变薄或丢失。视网膜电图表现为波幅低平或熄灭,或者视杆细胞反应的损害大于视锥细胞反应。视野的改变可见于所有患者,但视野缺损的形态不一,以环形暗点和弓形暗点最典型,也可见旁中心暗点或管状视野。
本例患者急性起病,发病4个月前曾确诊皮肤基底细胞癌,其临床表现及辅助检查均符合CAR诊断。我们检测了本例患者血清中的多种神经系统PNS抗体均为阴性,但遗憾的是我们未在国内找到相关公司检测其抗恢复蛋白抗体。即使无血清学检测结果的支持,依据患者全身病史、视力、眼底表现和电生理检查结果,仍可诊断为CAR。
CAR需与肿瘤放射及化学治疗的副作用、肿瘤的眼部转移性病变以及患者本身可能存在的急性区域性隐匿性外层视网膜病变、糖尿病视网膜病变、无色素性视网膜色素变性等视网膜病变相鉴别。本例患者未进行放射及化学治疗,可排除其治疗副作用。肿瘤的眼部转移性病变多位于葡萄膜尤其是脉络膜,多表现为眼球突出、运动受限、胀痛等。急性区域性隐匿性外层视网膜病变多见于中青年女性,眼底轻微病变,病灶位于视网膜外层及RPE-玻璃体-脉络膜毛细血管复合体层,不伴有光感受器的丢失。本例患者急性起病,视力迅速下降,双眼明显闪光感,既往无糖尿病病史,结合眼底表现,可排除上述病变。
本例患者未进行相关治疗。针对CAR的治疗目前已进行过多种尝试,包括口服糖皮质激素、免疫抑制剂、玻璃体腔注射抗血管内皮生长因子药物、血浆置换等,但有关其确切疗效尚不能明确。而且,对于任何一种方法的治疗反应和疗程评估均受患者存活时间的限制,治疗原发恶性肿瘤并不能提高其视力。