儿童Prader-Wdli综合征临床分析
Prader—Willi综合征(PWS)是由于染色体15q11-q13父源基因表达缺失所致的一种与基因印记相关的遗传性疾病,其发病率为1/25 000~1/15 000。PWS主要临床特征是新生儿期和婴儿期肌张力减退及吮吸困难、儿童期过度摄食导致的病态肥胖、身材矮小、促性腺激素分泌不足的性腺功能减退、行为异常、智力低下及特征性外貌。尽管1993年Holm等制定了详细的临床诊断标准,但由于PWS临床表现随年龄而变化,且缺乏特异性,易被漏诊及误诊。本研究对2012年7月至2014年12月于南京医科大学附属南京儿童医院就诊的10例疑似PWS患儿进行相关临床检查,并采用甲基化特异性聚合酶链式反应(MS—PCR)方法进行基因分析并确诊。结合10例PWS患儿的临床资料进行文献分析及讨论,以加强对PWS的认识,便于早期干预。
1资料与方法
1.1研究对象
以10例因肥胖伴智力低下、外生殖器异常等原因就诊的疑似PWS患儿为研究对象,参照Holm等旧1提出的PWS临床诊断标准。其中男4例,女6例;就诊年龄2岁10个月~13岁9个月;6例因食欲亢进、体质量进行增加就诊内分泌科,2例因隐睾就诊于泌尿外科,1例因极度肥胖引起阻塞性睡眠呼吸暂停低通气综合征(OSA)、心功能不全就诊于心脏科,1例因肺部感染就诊于呼吸科。
1.2临床资料
采用回顾性研究方法,分析患儿临床资料,包括临床特点、影像学检查、实验室检查以及神经心理发育评估,其中影像学检查包括垂体CT、左手腕骨龄、腹部B超,实验室检查包括血生化、口服葡萄糖耐量试验、性激素激发试验、生长激素激发试验。采用韦氏智力量表评估患儿精神心理发育。本研究经南京医科大学附属南京儿童医院医学伦理委员会批准。
1.3基因分析
在获得家长知情同意后抽取患儿及其父母血2 mL,送至南京金域医学检验所提取血液基因组DNA,根据PWS相关的15ql 1-q13 SNRPN基因外显子a区段上双亲来源甲基化的差异,通过MS—PCR方法对SNRPN基因进行分析。
2结果
2.1临床特征
10例患儿均有新生儿期及婴儿期肌张力低下、吸吮困难,随后出现食欲亢进、摄食过度以及体质量增长过快,见表1。除3例没有体质量指数(BMI)数据,余7例患儿就诊时BMI为26.3-39.7 kg/m2,达到肥胖标准。10例患儿均存在智力发育落后。4例男性患儿有隐睾(3例为双侧隐睾,1例为单侧隐睾)。1例(病例8)女性患儿青春期发育延迟,13岁9个月,无女性生殖器缺如或严重发育不良,未出现第二性征,性激素激发试验显示下丘脑-垂体-性腺轴尚未启动。病例2为矮小症,生长激素激发试验显示生长激素完全缺乏。7例患儿进行口服葡萄糖耐量试验,其中1例(病例1)糖耐量异常,2例(病例3,4岁;病例4,4岁7个月)胰岛素抵抗。5例患儿腹部B超显示脂肪肝。10例患儿血生化、垂体、肾上腺影像检查均未发现明显异常。其中病例1为极度肥胖患儿,出现严重OSA而最终死亡。
表1 Prader-Willi综合征10例患儿临床特征
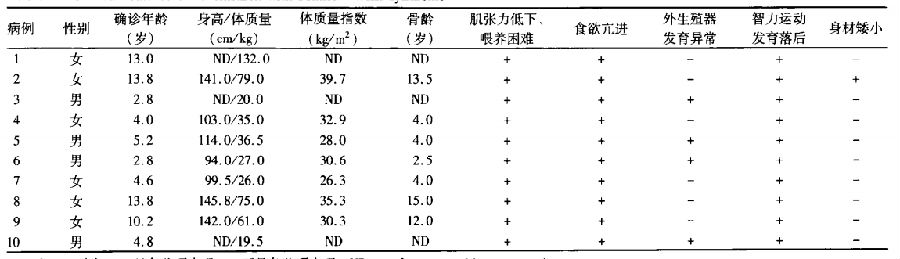
注:ND:未知;+:具备此项表现;一:不具备此项表
2.2基因分析
10例患儿均采用MS.PCR检测15号染色体的 SNRPN片段,均检出母源片段,而父源片段丢失,结合临床确诊为PWS患者。
3讨论
PWS是一种累及多系统的遗传性疾病,是引起人类肥胖最常见的遗传性疾病之一。PWS早期临床表现不具特异性,不易被早期诊断。本研究显示确诊的平均年龄约为6岁,没有在新生儿期被确诊病例,主要为因肥胖或青春期发育延迟就诊被发现并确诊。未经饮食控制和体质量管理的PWS患儿,会出现病态肥胖,以及肥胖相关的OSA、糖尿病甚至死亡。
病例l为极度肥胖患儿,出现OSA、心功能不全以及糖耐量 异常,并发生死亡,而引起死亡的主要原因与极度肥胖伴OSA有关。研究显示PWS患者患病及死亡风险增加,Tauber等总结 64例<20岁的PWS死亡病例,发现0—2岁死亡病例占61%, 3~5岁为28%,6~10岁为3%,11岁以上为8%,提出婴儿期和儿童期突发死亡与呼吸道感染相关,与是否存在肥胖、睡眠呼吸暂停以及有无生长激素治疗无关。肥胖增加了PWS患者死亡风险,且肥胖引起的心肺并发症是15岁以上PWS患者的主要死亡原因,提出早期诊断、早期生活方式干预、减少过度摄食,可减缓过度肥胖引起的并发症、减少早期病死率。
PWS患者呼吸道分泌物黏度大、颅面畸形所致呼吸道狭窄、肌张力低下引起呼吸道塌陷以及腺样扁桃体肥大等原因导致OSA发生。一般儿童OSA发生率为2%~3%,PWS患儿OSA发生率可达80%。腺样扁桃体切除术可以改善OSA,但术后仍有患儿发生OSA。2000年,生长激素应用于PWS治疗,可以改善PWS患儿的生长发育、脂肪利用、认知能力及肺活量,减少睡眠暂停次数、心血管事件风险等。研究报道生长激素治疗中发生患儿死亡事件,且生长激素治疗中PWS患儿死亡事件大多数(75%)发生在开始治疗的9个月内。这些患儿多存在严重肥胖、睡眠呼吸暂停或呼吸道感染。目前研究没有足够证据表明生
长激素治疗加重OSA。但对于≥2岁的PWS患儿,特别是在应用生长激素治疗前,应解决患儿上呼吸道梗阻情况,需进行口咽部检查,必要时应进行多导睡眠图检查,有扁桃体肥大者需考虑是否进行切除术。生长激素治疗前后都应监测睡眠呼吸。
PWS可引起糖代谢异常,出现2型糖尿病。本研究2例患儿出现胰岛素抵抗,1例患儿存在糖耐量异常。Brambilla等对109例2~18岁PWS患者(50例肥胖,59例非肥胖)研究发现
4例为2型糖尿病,肥胖PWS患儿胰岛素抵抗以及代谢综合征的发生率较高。PWS肥胖患儿具有较低的胰岛素水平和较高的胰岛素敏感性,可能与脂肪分布差异、低水平生长激素以及较高水平胃饥饿素相关。PWS患者在儿童时期很少发生2型糖尿病或糖耐量异常,但约25%PWS成年患者在平均20岁出现2型糖尿病。早期诊断及合理控制体质量是预防肥胖及减少糖代谢并发症的关键。肥胖及使用生长激素治疗的PWS患儿需评估糖尿病及代谢综合征风险。
PWS主要由于染色体15q11一q13父源基因表达缺陷引起,PWS分子缺陷类型包括父源基因缺失、母源单亲二倍体、印记缺陷。本研究未获得患儿双亲的遗传信息,未能进行基因缺陷类型鉴别。
总之,PWS患儿新生儿期及婴儿期有典型的临床表现,但不具特异性,新生儿期易被漏诊、误诊,儿童期往往因肥胖、性发育不良、青春期发育延迟,以及肥胖引起的糖代谢异常、心肺并发症等就诊,其中涉及内分泌科、泌尿外科、呼吸科及心血管科等多专 科。目前对本病无特异性治疗方法,多采用综合治疗,而早期诊断、早期干预对提高患者生存率、生活质量具有重要意义。







