肿瘤相关性骨软化症病例分析-2
讨论
TIO是一种主要由肿瘤分泌FGF-23引起磷代谢异常造成的获得性低磷性骨软化症。本例患者以低磷血症、骨软化、骨痛、肢体无力及活动障碍为主要表现,肿瘤体积小、进展缓慢,病理提示不典型梭型细胞,结合患者病情符合磷酸盐尿性间叶肿瘤(PMT),术后第4d血磷即恢复正常,故最终确诊为“低磷性骨软化(肿瘤性)”。患者术后3个月症状基本消失,随访2年余恢复可。北京协和医院冯娟等对144例TIO患者进行的一项回顾性研究显示,该病患者从起病至明确诊断的平均时间为2.9年,而从起病至手术切除肿瘤的时间平均长达5.4年。本例患者尽管具有典型的低磷性骨软化临床特点及生化特征,但仍被长期误诊、误治。可见大多数医生对本病认识不足,临床上易出现误诊、误治,因此作为临床医生提高对本病的认识是十分必要的。
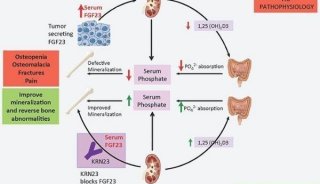
发病机制:本病发病机制尚不完全明确,目前认为患者磷代谢紊乱与致病肿瘤分泌的FGF-23有关。FGF-23是一种目前已证实的参与磷代谢的调磷因子,其机制已得到较完整的描述:TIO患者责任肿瘤可大量分泌FGF-23,超出体内水解蛋白酶对其灭活的活性,导致血液中FGF-23水平升高;FGF-23通过血液循环到达肾脏,作用于肾脏内Klotho蛋白(FGF-23受体结合调节蛋白),调节近端肾小管钠-磷共转运蛋白IIa(Na-PiIIa)并抑制1-α羟化酶功能进而使1,25-二羟基维生素D3(1,25(OH)2D3)降低和抑制磷的重吸收,最终导致低磷血症、骨矿化障碍、骨软化。目前已知的调磷因子有FGF-23、人分泌型卷曲相关蛋白-4(sFRP-4)、细胞外基质磷酸糖蛋白(MEPE)等。姜艳等研究提示MEPE可能与FGF-23在TIO发病中起协同作用;T.Shimada等研究表明sFRP-4可能具有磷酸化蛋白的功能,能够促进尿磷增加和低磷血症,并直接代偿性增加1α,25-二羟基维生素D,影响肾脏的磷代谢。
临床特点:TIO是由肿瘤导致血磷代谢紊乱而引起的低血磷性骨软化症,多起病于成年人,仅极少数病例在青春期前起病。结合本例患者情况,TIO典型的临床特征表现:起病缓,病程长,以进行性骨痛伴肢体无力为主要表现,骨痛以四肢及负重关节为重,严重者可有活动障碍、肢体短缩甚至骨折等。经典的生化特征:血磷降低、正常的钙及甲状旁腺激素、较低的1,25(OH)2D3及碱性磷酸酶的升高。骨密度检查多提示骨质疏松。典型X线表现为骨小梁模糊、假性骨折、椎体可呈双凹征、骨盆出现三角样改变等,与其他骨软化症无明显区别。引起TIO的肿瘤部位较隐匿,体积往往很小;手术切除肿瘤后,血磷很快恢复正常,症状逐渐缓解。
组织病理学:最初,Weidner等在1987年首次将与TIO相关的肿瘤命名为PMT,并将其分为四个亚型:混合结缔组织变异体型(PMTMCT),骨母细胞瘤样变异体型,非骨化纤维瘤样变异体型,和骨化纤维瘤样变异体型。但是,2004年Folpe等分析了32例骨软化相关肿瘤病理学特征,并重新总结和修正现有文献报道的109例TIO的肿瘤病理学诊断,认为几乎所有PMT都属于一种独立组织病理学类型,即PMTMCT。PMT典型的组织病理学表现包括:肿瘤组织主要由肥胖的梭形细胞,伴或不伴有一些破骨细胞样多核巨细胞;间质富于厚壁畸形、鹿角样、血管外皮瘤样等多种类型血管,部分还可见成熟的脂肪组织;细胞常嵌套在软骨样或骨样基质中,形成絮状钙化,称作“污垢样结构”;细胞核分级及有丝分裂活性相对较低。PMT通常为良性,但恶性及转移性肿瘤也偶有报道。在大多数情况下恶性PMT表现为肉瘤的特征,如明显的核异型性、较多的核分裂和升高的有丝分裂活性,类似于未分化的多形性肉瘤。PMT组织成分多样,血管形态结构丰富,形态学改变不具有特征性,临床上需要与多种肿瘤鉴别,如血管平滑肌脂肪瘤、软骨黏液样纤维瘤、间叶性软骨肉瘤、血管外皮细胞瘤、腱鞘巨细胞瘤、巨细胞修复性肉芽肿、硬化性血管瘤等。故需密切结合患者临床表现、实验室检查以确诊PMT。本例患者病理学检查提示不典型梭型细胞,符合PMT表现,故TIO诊断明确。
定位诊断:TIO完全切除致病肿瘤后,预后较好,因此如何准确的定位致病肿瘤对TIO的治疗是本病的关键。目前多种影像学技术应用于TIO致病肿瘤的诊断。徐加利等认为CT、MRI均可发现及清楚的显示病变,对于已排除其他病因的低磷性骨软化症患者可作为提示性诊断,但由于其表现不具有特征性,行全身扫描费时费力,故不适合用于寻找责任肿瘤。TIO责任肿瘤多来自于间叶组织,而间叶组织来源的肿瘤通常有生长抑素受体(SSTR)存在,因此可以使用生长抑素受体显像来寻找致骨软化的肿瘤。奥曲肽是生长抑素类似物,可与生长抑素受体结合,用于生长抑素受体显像来定位肿瘤。Jing等研究表明99mTc标记的肼基联氨基烟酰胺奥曲肽(99mTc-HYNIC-TOC)全身扫描准确率达93.4%。F-18FDG-PET/CT也是一种定位TIO责任肿瘤的敏感方法,但该显像方法仍不具备特异性,且价格昂贵仅在部分大型医院开展此项检查,故通常仅用于不明原因且高度怀疑TIO者的诊断。近年有研究显示68Ga-DOTATATEPET已经成为一种理想的TIO责任肿瘤定位方法,相比于F-18FDG-PET/CT更有优越性,甚至能检测出111In-oc⁃treotideSPECT/CT未能发现的肿瘤。责任肿瘤分泌FGF-23是TIO的重要致病机制,全身静脉分段取血测定FGF-23对于大多数患者的责任肿瘤的定位具有重要价值。TIO责任肿瘤多体积较小、生长缓慢,且部位隐匿,大多数定位手段不具备特异性,定位诊断十分困难。因此,将患者临床表现、实验室检查与多种定位手段相结合显得尤为重要。
鉴别诊断:TIO的诊断主要依据临床表现、实验室检查、影像学检查等,目前尚无统一的诊断标准,多为排除性诊断。临床上需要与以下疾病相鉴别:(1)遗传性低磷血症:①X连锁显性遗传性低磷性骨软化症(XLHR):是遗传性低磷血症中最常见的类型,以X性染色体显性方式遗传。该病致病基因是X染色体上内肽酶同源的磷调节基因(PHEX)。PHEX突变导致FGF-23和MEPE的表达异常,FGF-23升高,肾近端肾小管重吸收障碍引起低血磷性骨软化症;②常染色体显性遗传性低磷性骨软化症(ADHR):是由于FGF-23基因突变导致其蛋白水解受阻,体内FGF-23水平升高导致的低磷性骨软化症;③常染色体隐性遗传低磷性骨软化症(ARHR):以常染色体隐性遗传的方式遗传,主要与DMP-1基因突变有关。XLHR、ADHR、ARHR均表现为典型的低血磷症,可有骨软化表现。但TIO是由肿瘤导致的副瘤综合征,体内有责任肿瘤,而XLHR、ADHR、ARHR是由基因突变引起的遗传性疾病,常有家族史,临床上不难鉴别;(2)原发性甲状旁腺功能亢进症:是由于甲状旁腺自身病变如增生、肿瘤等引起的甲状旁腺激素合成与分泌增多,导致的高血钙及低血磷症,临床表现为反复发作的肾结石、血尿、不明原因的骨痛、消化系统溃疡、高血压、精神神经病变。通过测定体内甲状旁腺激素含量及临床表现不难与TIO相鉴别;(3)原发性骨质疏松症:是一种以骨矿含量降低和骨显微结构破坏为特征,骨脆性增加,易发生骨折的全身代谢性疾病,分为绝经后骨质疏松、老年性骨质疏松和特发性骨质疏松。此病多是随年龄增长发生的一种生理性退行性变,给予补充钙磷等临床症状可缓解;(4)多发性骨髓瘤:是一种浆细胞的恶性克隆性疾病,以骨髓中恶性浆细胞克隆性增生为特征,临床多表现为贫血、溶骨性病变或/和广泛性骨质疏松,可有高钙血症、骨痛、病理性骨折及神经压迫症状。本病多有血清异常蛋白增多,尿本周蛋白阳性,结合临床症状不难与TIO相鉴别;(5)症状性Tarlov囊肿:常见腰腿痛的原因之一,中年女性患者多见,好发生于骶管内的神经根囊肿,临床症状多为腰骶部及下肢的疼痛不适,同时伴随轻度大小便功能障碍、会阴区麻木或间歇性跛行,骶尾部MRI可发现囊性病灶,生化检查多正常,不难与TIO相鉴别;(6)Fanconi综合征:由多种肾小管功能障碍所致的一组水电解质酸碱代谢紊乱为特征的临床征候群,常有肾性糖尿、多种氨基酸尿、高钙尿症、低磷血症等多种表现。①遗传性Fanconi综合征:是以肾小球近端小管联合功能受损为主要发病机制的常染色体显性遗传综合征。②获得性Fan⁃coni综合征:常见原因有多发性骨髓瘤、肾病综合征、重金属中毒、药物因素等。Fanconi综合征可有低磷血症表现,但除典型的低血磷症表现外常有多种肾小管功能障碍,且遗传性Fanconi综合征多有阳性家族史,获得性Fanconi综合征有原发疾病或相关致病因素,故临床上与TIO不难鉴别;(7)药物性低磷性骨软化症:①部分抗惊厥药能够加强肾脏对磷酸盐的重吸收、降低1α-羟化酶活性,导致低磷血症骨软化症。②阿德福韦酯(ADV)是成人低磷性骨软化症的重要发病原因,具有肾毒性和剂量依赖性,大剂量或长期低剂量使用可导致药物浓度增加,线粒体DNA合成抑制,细胞色素氧化酶缺陷,线粒体功能降低和肾小管上皮细胞凋亡,肾小管重吸收功能异常,最终导致低磷性骨软化症。药物导致的低磷性骨软化症多有明确的药物服用史,因此不难鉴别;(8)消化系统疾病:由于吸收不良综合征(例如克罗恩氏病,溃疡性结肠炎,乳糜泻和空肠回肠旁路肥胖症)引起的维生素D缺乏可能引起骨软化;(9)环境因素:如长期缺乏阳光可导致维生素D吸收障碍,引起低磷性骨软化症。
治疗及预后:TIO是一种责任肿瘤导致磷代谢紊乱的副瘤综合征,手术切除责任肿瘤往往有较好的效果。但近年有研究显示即使广泛的肿瘤切除,仍有转移或复发可能,因此,手术切除责任肿瘤后患者仍需长期随访。如果肿瘤不能完整切除,可通过补充磷酸盐和骨化三醇等药物进行治疗,血清磷及临床症状可有一定程度的改善,但血磷无法恢复到正常水平。KobayashiH等认为3D荧光透视导航技术辅助手术有利于TIO责任肿瘤的切除,降低局部复发率。MorimotoT等研究认为阿奇霉素可一定程度上抑制肿瘤,对恶性和转移性TIO的治疗有一定价值,但仍需进一步研究。2014年一项I期临床试验结果提示对于XLHR患者,使用抗FGF-23抗体具有良好的安全性和有效性,而TIO与XLHR发病机制相似,该抗体可能对TIO有一定的治疗价值。2017年,NairA等首次提出使用放射性核素肽受体治疗恶性TIO,对指导恶性TIO的治疗有一定意义。CowanS等报道了1例TIO的治疗患者使用CT冷冻消融实现了生化及临床症状恢复,扩大了TIO患者尤其是拒绝手术和不能耐受手术患者的选择范围。本例患者肿瘤切除后,血磷很快恢复正常,症状3个月左右即完全缓解,经过2年随访,未出现复发及转移,预后较好。
结论
TIO是临床上一种少见的副瘤综合征,当患者出现不明原因的进行性骨痛伴肢体无力,实验室检查提示血磷降低、尿磷增加,需考虑此病可能。肿瘤生长缓慢,位置隐蔽,PMTMCT为其主要病理类型。全身影像学检查对肿瘤定位有重要意义,但目前尚无特异性定位手段。临床上多为排除性诊断,需与多种疾病鉴别。临床容易漏诊或误诊,但早期手术完整切除责任肿瘤可获得良好的预后。由此可见,提高对本病的认识,及时发现肿瘤十分重要。
-
仪器推荐
 询底价 Tel:400-6699-117 转 7335
询底价 Tel:400-6699-117 转 7335 -
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
焦点事件