一例肿瘤性骨软化症病例分析
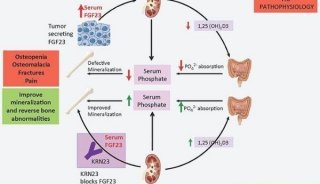
肿瘤性骨软化症(tumor-induced osteomalacia,TIO)是一种临床罕见的伴瘤综合征,由McCance于1947年首次报道,至今全世界报道300余例,因肿瘤细胞分泌调磷因子(主要为成纤维细胞生长因子23,fibroblast growth factor23,FGF23),导致肾小管磷重吸收障碍,血磷降低,骨矿化不全。
TIO在临床上主要表现为骨痛肌无力骨折甚至活动受限实验室检查表现为低血磷,肾排磷增加,肾小管磷重吸收率下降,血活性维生素D水平正常或降低,X线表现为普遍性骨质疏松或假骨折该病起病隐匿,从开始出现症状到确诊时间长,病程可为1.5~28年,造成患者反复住院,生活质量差,医疗费用高。肿瘤细胞多为间叶来源,良性者居多,可有远处转移的恶性表现,手术切除后恢复良好,若能早期诊断,早期发现肿瘤病灶,可减少住院频率及医疗费用,有助于提高生活质量,现报道1例TIO患者的临床资料,并复习相关文献进展,以提高对该病的认识。
临床资料
患者,男,48岁。因进行性全身骨关节痛2年半,于2012年9月入院治疗。患者2年半前开始出现右脚踝关节痛,并逐渐出现后背双侧髋关节膝关节痛,以运动时加重,活动障碍,生活质量差,2年来身高降低9 cm,曾诊断为骨质疏松症,口服钙剂及骨化三醇治疗,症状无改善。
体检:T36.4℃,P70次/min,R19次/min,BP134/97mmHg,蹒跚步态,全身骨关节有压痛,胸廓前凸。
辅助检查:血磷0.42mmol/L(正常值0.81~1.45mol/L,下同),血钙2.02mmol/L(2.15~2.55mmol/L),碱性磷酸酶199U/L(40~129U/L),25-OH-D327ng/mL(<20ng/mL,维生素D缺乏;20~29ng/mL,维生素D不足;30~100ng/mL,理想水平),骨钙素型胶原交联羧基端肽及甲状旁腺素正常,总型前胶原氨基端肽67.0ng/mL(15.3~52.7ng/mL),血气分析正常,尿常规正常,8Am、4Pm及12MN皮质醇分别为124.3g/L(62~194g/L)49.6g/L69.9g/L,性激素:泌乳素16.36ng/mL(2.64~13.13ng/mL),孕酮促卵泡激素雌二醇睾酮正常,HLA-B27阴性,抗核抗体抗心磷脂抗体类风湿因子阴性,血沉正常。
肿瘤标志物:甲胎蛋白、癌胚抗原、糖链抗原19-9、总前列腺抗原、神经元特异性烯醇化酶、鳞状细胞癌相关抗原均正常,血尿蛋白电泳均无M蛋白。
骨骼99mTc-MDP显像示:双侧肋骨与肋软骨连接处对称性放射性增浓,双侧髂关节对称性放射性增浓。双能X线骨密度检查:腰椎T值=-2.9SD肾小管磷重吸收率(%TRP)为65.8%(85%~95%)。
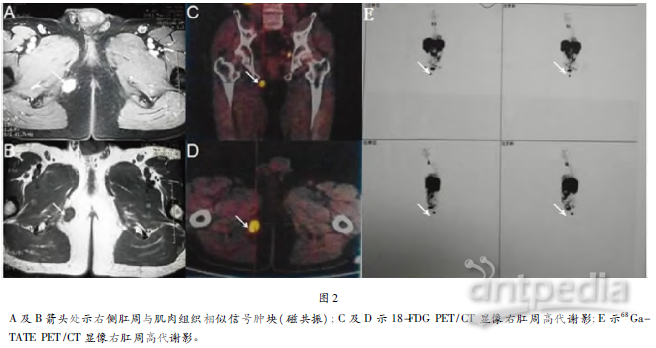
经院内会诊怀疑为TIO,进一步行下列检查:99mTc-HTOC(99锝标记生长抑素受体显像)未发现占位性高信号病变,见图1;68Ga-TATE(68镓标记生长抑素类似物)PET/CT检查示右肛周1.6 cm×2.9 cm×2.4 cm高信号影,SUV值6.1AVG,见图2;18-FDG(18氟葡萄糖)PET/CT检查示右肛周1.6 cm×3.0 cm×1.8 cm高信号影,SUV值2.0AVG,见图2;盆腔MRI:右侧肛周旁皮下软组织内类圆形异常信号,与盆壁肌肉组织信号相似,等T1稍低T2信号,边界清,1.4 cm×2.1 cm×2.0 cm,增强呈明显强化,血供丰富,见图2;肢体彩超:右股骨根部内后近臂部软组织层内可见低回声,形态欠规则,内回声不均,似有包膜,大小2.1 cm×1.6 cm×1.7 cm,距体表1.7 cm,内部及周边可见较丰富动静脉血流。
在连续硬膜外麻醉下行肛周肿块切除术,术后第127天查血磷0.64mmol/L1.12mmol/L1.07mmol/L。术后第9天肾小管磷重吸收率为91.4%。病检结果:右肛周磷酸盐尿性间叶组织肿瘤,混合性结缔组织亚型,见图3。

术后继续口服钙剂及骨化三醇治疗1个月后骨痛症状明显缓解,术后6个月复查骨密度腰椎T值=-1.8SD。
讨论
TIO被认为是一种伴瘤综合征,主因肿瘤细胞分泌调磷因子致肾脏排磷增加目前多数研究认为FGF23是与TIO相关性最高的调磷因子,FGF23主要作用于近端肾小管,促进钠-磷共转运蛋白IIa(NaPi II a)的内移和降解,减少NaPi II a的募集和表达,降低磷的重吸收,导致尿磷排泄增加,血磷降低,同时FGF23还影响25-OH-D3的1α羟化,导致1,25-(OH)2-D3水平下降,影响磷酸盐在小肠的摄取。White等在TIO患者血清中发现FGF23明显升高,肿瘤切除后FGF23恢复正常,证实本病与FGF23的相关性。柯耀华等对1例TIO患者血清FGF23水平进行检测,发现术前FGF23明显升高,术后显著下降FGF23升高亦可见于骨囊性动脉瘤及软骨粘液纤维瘤。另外,研究表明分泌性卷曲相关蛋白-4(frizzled related protein-4)、细胞外基质磷酸糖蛋白(matrix extracellular phosphoglycoprotein,MEPE)成纤维细胞生长因子7(roblast growth factor7,FGF7)等也可能与TIO相关。
引起TIO的肿瘤来源于间叶组织,大多为良性,体积小,生长缓慢肿瘤多位于骨和软组织内,常见于四肢,其次为头面部躯干。肿瘤可附着于骨骼表面,也可位于软组织表面或深层血管瘤或血管内皮瘤占50%以上,其次为纤维瘤纤维肉瘤成骨细胞瘤巨细胞瘤等,对于病理组织类型不典型者结合临床与病理特点称为磷酸盐尿性间质肿瘤,混合结缔组织亚型(phosphaturic mesenchymal tumor,mixed connective tissue variant,PMTMCT)。肿瘤多为良性,约10%为恶性,恶性者多见于前列腺癌,部分肿瘤可发生远处转移(如肺内转移)。
对于临床无骨质疏松家族史,青春期后起病,进行性骨关节痛肌力降低步态异常,低磷血症,血钙正常或降低,血活性维生素D水平正常或降低,PTH一般正常(若维生素D水平下降,PTH可继发性升高),X线表现为普遍性骨质疏松的患者需高度怀疑本病,其中低磷血症为诊断的关键点TIO患者低磷血症主因调磷因子致尿磷重吸收障碍尿磷排泄增加所致。可通过计算肾小管磷重吸收率%(percent tubular reabsorption of phosphate,%TRP),[%TRP=100×(1-(尿磷/尿肌酐)×(血肌酐/血磷)),正常范围为85%~95%]来评估尿磷的排泄。对于怀疑TIO者需仔细寻找肿瘤病灶,部分患者可经详细的体格检查而发现,分段静脉采血测定FGF23水平99mTc生长抑素受体显像18F葡萄糖PET扫描68Ga标记生长抑素类似物PET检查等对于肿瘤的定位诊断有重要意义。
本例患者99mTc-HTOC未发现肿瘤病灶,进一步行68Ga-TATE PET/CT及18-FDG PET/CT检查发现右肛周肿瘤,说明对于怀疑TIO者,一种影像学检查未发现病灶时,进行多种影像学检查有助于提高诊断率。
本病需与具有低磷血症的骨质疏松症患者相鉴别,常见于甲状旁腺功能亢进症及低血磷性骨软化症中的其他类型(常染色体显性低磷性佝偻病、X连锁显性低磷性佝偻病、散发性低血磷性骨软化症)。甲状旁腺功能亢进症患者PTH及血钙明显升高可与之鉴别。常染色体显性低磷性佝偻病、X连锁显性低磷性佝偻病多于青春期前起病,常有明确家族史,散发性低血磷性骨软化症多无家族史,常于中青年起病,与TIO患者类似,鉴别困难,直到发现TIO患者肿瘤病灶才能最终鉴别。
一般来说,完整切除肿瘤可治愈本病,因有术后复发可能,需扩大切除范围,术后监测血磷,可早期发现复发。巴建明等报道12例肿瘤性骨软化症患者,9例1次手术治愈,另2例行3次手术后仍有1例血磷未恢复正常,另1例2次手术后治愈,说明手术可治愈本病,亦说明完整切除瘤体的必要性。射频消融(radiofrequency ablation,RFA)治疗亦有效,Hesse等报道1例右股骨头TIO患者进行射频消融治疗后症状及临床指标均明显恢复,随访1年无复发。Tutton等报道无水酒精注射及冷冻疗法亦可治愈TIO。部分肿瘤不能定位或无法切除者,可补充中性磷及骨化三醇改善症状。
-
焦点事件