腰椎管内间叶性肿瘤致低血磷骨软化症病例报告
肿瘤相关性低血磷性骨软化症(TIO)是一种由肿瘤引起肾脏排磷增加造成的获得性低血磷性骨软化症,临床表现为肌无力、骨痛,严重者出现骨骼畸形、骨折、活动障碍,显著影响生活质量,切除肿瘤后,病情可以获得明显缓解。TIO肿瘤大多为来源于间叶组织的良性肿瘤,最好发于四肢、头颈颌面部,椎管内肿瘤导致的低血磷骨软化症尚未见报道。现将北京协和医院神经外科手术治疗的腰椎管内间叶性肿瘤致低血磷骨软化症1例报告如下。
临床资料
患者女性,63岁,因“全身骨痛2年余、不能行走1年余”于2015年4月就诊北京协和医院。患者于2012年12月无明显诱因出现双髋关节酸胀性疼痛,双下肢跛行,爬楼后疼痛加重,骨痛渐延至腰背部、胸肋部及双下肢。于2013年4月仅能平地缓慢步行,无法爬楼,双上肢上举、翻身均困难,生活不能完全自理。于2014年1月起只能床上活动,无法走路,需家人照顾日常起居。在外院被诊为“骶髂关节炎”,治疗效果不满意,转来北京协和医院就诊。查血钙2.43mmol/L、血磷0.57mmol/L、碱性磷酸酶(ALP)373U/L、甲状旁腺激素(PTH)47.4pg/ml;髋关节、腰椎正侧位X线片示骨质疏松、骨质软化。患者近3年来身高下降187.5px(162→3862.5px),牙齿脱落2颗。既往史:7年前因“Ⅱ度房室传导阻滞”行“心脏起搏器植入术”,家族中无类似病史。
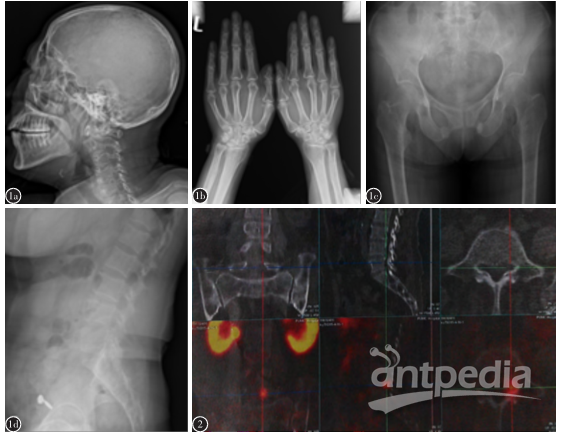
查体:发育正常,体型中等,轮椅入室,神清语利,胸廓挤压痛(+),骨盆挤压痛(+)。脊柱前伸、后屈及侧弯均受限,胸椎、腰椎、骶骨压痛均(+),双上下肢肌力4级。提示“低磷性骨软化症”可能性大。入院后行头颅、双手、骨盆及腰骶椎X线片示诸骨骨质疏松(图1);68Ga-PET/CT示:L5椎体椎弓根内侧可见代谢增高软组织密度灶,考虑为肿瘤相关性低磷骨软化病灶可能(图2);增强CT示:L5椎管内软组织结节并明显强化,符合TIO病灶表现,胸腰椎骨质疏松,双侧部分肋骨陈旧性骨折(图3)。因有心脏起搏器植入,未行任何MRI检查。
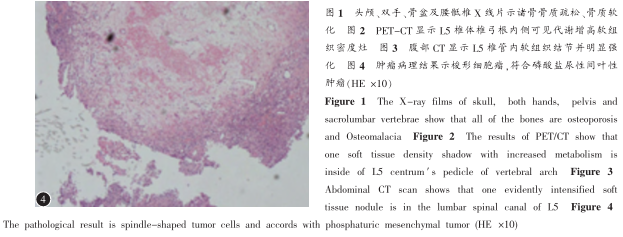
患者需每日口服中性磷及活性维生素D3维持血磷水平正常。完善术前准备后于5月13日在全麻下行L5椎管内占位病变探查、切除术,术中见占位病变直径约25px,呈暗红色,与硬脊膜可分离,质稀软似鱼肉样,血运丰富,显微镜下全切肿瘤。患者术后恢复良好,骨痛减轻,未再口服中性磷,仅给予口服钙剂及活性维生素D3,复查血磷呈缓慢上升趋势,术后第1、3、5、7、9天均复查血磷,结果分别为0.40mmol/L、0.47mmol/L、0.55mmol/L、0.60mmol/L、0.67mmol/L。病理结果示:(L5椎管内硬膜外肿瘤)梭形细胞瘤,结合病史符合磷酸盐尿性间叶性肿瘤(图4)。患者术后9d出院,出院时骨痛症状基本消失,可自行下地活动,恢复良好。
讨论
TIO是由肿瘤引起肾脏排磷增加造成的获得性低血磷性骨软化症。临床表现为乏力、骨痛,严重者出现骨折、骨骼畸形,生化特点为血磷降低,尿磷增多,血1,25-二羟基维生素D3[1,25(OH)2D3]水平降低或正常。TIO肿瘤切除后,血磷恢复正常,症状显著改善。
TIO起病隐匿,病程长,诊断困难,具有以下临床特征:(1)骨痛为最主要症状,多在四肢及负重关节,亦可发生在躯干骨,如胸骨、肋骨,常在无明显外伤情况下发生隐匿性骨折,致骨痛症状更为严重,后期不能下地活动;(2)血磷明显降低,尿磷增高,ALP升高,需要大剂量持续补充中性磷及活性维生素D3才可将血磷升至正常;(3)血1,25(OH)2D3水平降低,可伴有继发性甲状旁腺功能亢进,表现为高血钙、低血磷等;(4)骨骼X线检查可见骨密度降低,骨小梁模糊,有时可见假性骨折;骨密度检测提示骨密度减低;(5)可发现相关肿瘤,肿瘤常较小而隐蔽,肿瘤切除后临床症状和生化检查一般可在2周内得到改善。
TIO肿瘤主要为血管瘤或血管内皮瘤,其次为纤维瘤、纤维肉瘤、巨细胞瘤、梭形细胞瘤等间叶组织来源的肿瘤。TIO的发病机制尚未完全明确,可能与TIO肿瘤产生一种或多种导致肾脏排磷增加的因子有关。成纤维细胞生长因子23(FGF-23)是一种在TIO肿瘤中过度表达的一种因子,被认为具有降磷素特性,其主要是通过调节近端肾小管钠-磷共转运蛋白Ⅱa(NaPiⅡa)和1-α羟化酶的活性而致病。FGF-23与肾小管上皮细胞基底缘的受体结合后抑制NaPiⅡa的表达,使肾脏排磷增加,同时FGF-23可抑制1-α羟化酶的活性,导致维生素D生成不足,加重低磷血症。另有研究表明,细胞外基质磷酸糖蛋白(MEPE)和弯曲相关蛋白4(FRP-4)也具有降低血磷或致佝偻病作用,TIO肿瘤亦可能表达上述两种蛋白致低血磷骨软化症。
Folpe等提出大多数引起低血磷性骨软化症的间叶肿瘤本质上属于同源,可统称为“尿磷性间叶肿瘤混合多种结缔组织变体(PMTMCT)”,其主要由梭形细胞和破骨细胞样多核巨细胞组成,其中梭形细胞表达FGF-23,可能是真正的肿瘤实质细胞。本例患者术后病理结果为梭形细胞瘤,结合病史符合磷酸盐尿性间叶性肿瘤,符合TIO肿瘤病理特征。
TIO患者实验室检查均提示有低血磷、高尿磷,血1,25(OH)2D3水平低下;X线检查可表现为全身性骨质脱钙,骨密度降低,假骨折线,骨小梁减少,尤以骨盆、腰椎、双手为著。对于原因不明的低血磷性骨软化症患者,给予中性磷溶液及活性维生素D3治疗后开始疗效明显,但随后症状未能缓解,或者加重者,应考虑TIO。确诊TIO诊断的关键是明确肿瘤的位置及手术切除肿瘤后临床症状的改善、检查及化验指标恢复正常。该病的肿瘤部位在人体分布较广,可出现在皮肤、皮下组织、鼻咽部、鼻窦、骨骼、手掌、足趾等处,最常见于下肢、头颈部和上肢,通过详细的体格检查及询问病史可发现有些位于体表的肿瘤,B超对体表小肿瘤的诊断很有价值。
位于深处及特殊部位的肿瘤普通检查难以发现,需要敏感性及特异性均高并能全身兼顾的检查手段。PET/CT将PET与CT融为一体,由PET提供病灶详尽的功能与代谢等分子信息,而CT提供病灶的精确解剖定位,一次显像可获得全身各方位的断层图像,具有灵敏、准确、特异及定位精确等特点,可一目了然的了解全身整体状况,无疑是发现隐匿性TIO肿瘤的最佳检查手段。本例患者TIO肿瘤位于L1椎管内,位置隐匿,入院后行68Ga-PET/CT发现L5椎体椎弓根内侧可见代谢增高软组织密度灶,考虑为TIO病灶,并进一步行增强CT证实。由于该患者有心脏起搏器植入,未行MRI检查。而MRI检查对诊断TIO很有价值。对于有特殊原因无法实施MRI检查的患者,PET/CT是其定位、定性诊断的最佳手段。
手术切除TIO肿瘤是最佳治疗措施,一般术后1~2周血磷即可恢复正常,半年内症状能得到显著改善。体表肿瘤,手术难度较小,但是对于椎管内肿瘤,手术切除难度大、风险高。目前国内尚未见有椎管内肿瘤致TIO的报道,本例患者椎管内肿瘤体积较小,并未引起脊髓及脊神经根压迫刺激症状,手术目的为完整切除肿瘤,纠正肿瘤所导致的低血磷,因此术前确定椎管内占位即责任肿瘤尤为重要。本病例在术后第1、3、5、7、9天血磷水平逐渐上升,接近正常水平,术后第1天疼痛显著减轻,术后第5天可下床活动,症状改善明显,术后未再服用中性磷,继续给予钙剂及活性维生素D3治疗,目前继续随访中。
综上所述,由于TIO较少见,多数医师对本病认识不足,容易导致TIO患者不能及时接受正确诊治。检索文献,TIO肿瘤位于椎管内者尚未见报道,本例患者在发病3年、生活不能自理1年后才确诊。因此,当患者存在低磷性骨软化症的临床表现、对症治疗难以纠正血磷异常时,需要警惕TIO的可能。难以明确病灶时,PET/CT是定位肿瘤的有效手段。一旦发现可疑病灶,应积极予以切除活检,一方面可尽快明确病因,另一方面若病灶即为TIO责任肿瘤,切除病灶后患者即可得到有效治疗。





















