纳米片递送量子点技术用于活细胞标记微管骨架
量子点做为无机合成的纳米荧光探针,具有高荧光亮度和荧光稳定性,适合长时间观察和活体示踪。将量子点靶向递送入细胞浆,有助于细胞内蛋白瞬时相互作用研究,以及动态细胞学反应机制的长时程观察。目前量子点递送入细胞的方法主要分为两类:①协助递送策略:利用穿膜肽、多聚物载体、转染试剂等实现量子点的递送,但是需要考虑量子点被细胞内吞后的释放效率;②主动递送技术:包括电穿孔和显微注射,会对细胞造成一定程度的机械损伤。加州大学Shimon Weiss课题组,将光热纳米片技术(Photothermal nanoblade technique)用于量子点偶联物的细胞内递送,不需考虑内吞后的释放效率,同时避免了机械损伤。
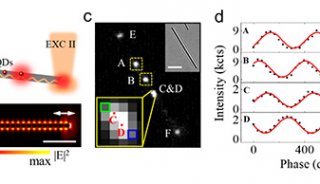
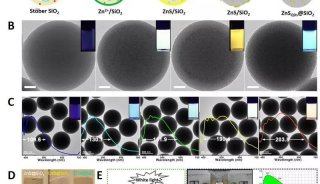
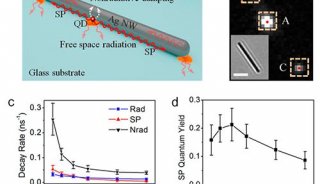
研究者将激光脉冲作用于毛细管吸头的表面等离子体振子,使其紧邻的细胞膜部位形成纳秒级爆炸性气泡,这些气泡在细胞膜上瞬时形成切口或孔洞;同时,向毛细管施压,形成一股瞬时液流,量子点偶联物随之进入胞浆(图1a)。与传统的显微注射方法比较,光热纳米片与细胞膜的接触更加温和,避免了对细胞的机械损伤。上述研究者将该技术用于微管蛋白-量子点偶联物的递送,实现了活细胞内微管骨架的实时观察。如图1所示,研究者对于偶联策略进行了改进。如果采用一步法直接将量子点与微管蛋白进行偶联(图1c),递送入细胞后,量子点可能阻碍微管组装。为了克服该问题,研究者设计了多步骤的偶联策略(图1b):①体外进行微管单体的聚合;②向微管聚合物中加入活化的量子点;③终止反应;④使微管聚合物解聚,纯化量子点-微管蛋白偶联物。研究者将获得的偶联物,以光热纳米片技术递送入细胞,清晰显示了微管骨架的丝状结构,并可长时间观察而没有淬灭(图2)。该方法充分利用了量子点在荧光成像中的优势,为细胞骨架的活细胞实时观察提供了新的研究手段。

图1 量子点与微管蛋白的偶联以及偶联物的递送模式图
(a) 利用光热纳米片技术将量子点-微管蛋白偶联物递送入细胞浆;(b) 多步法量子点-微管蛋白偶联策略;(c) 一步法量子点-微管蛋白偶联策略。

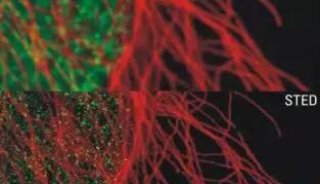
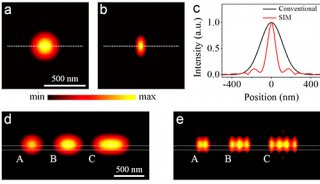
图2 Hela细胞的微管骨架成像
(a) 以多步法策略获得的量子点-微管蛋白偶联物在Hela细胞成像;(b) 以微管蛋白抗体对(a)图细胞进行免疫细胞染色成像;(c) (a)及(b)的叠加;(d) 未偶联的量子点在Hela细胞成像;(e) 以微管蛋白抗体对(d)图细胞进行免疫细胞染色成像;(f) (d)及(e)的叠加。
文献来源:
Xu J, Teslaa T, Wu TH, Chiou PY, Teitell MA, Weiss S. Nanoblade delivery and incorporation of quantum dot conjugates into tubulin networks in live cells. Nano Lett. 2012;12(11):5669-72.
-
焦点事件

-
焦点事件

-
精英视角
-
项目成果

-
企业风采

-
项目成果
-
科技前沿

-
会议会展
-
焦点事件

-
企业风采

-
科技前沿

-
科技前沿

-
焦点事件

-
焦点事件

-
项目成果

-
会议会展

-
科技前沿

-
项目成果
-
科技前沿

-
项目成果
-
企业风采
-
科技前沿

-
科技前沿
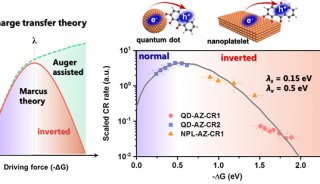
-
科技前沿
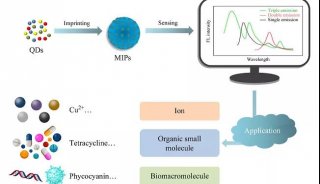
-
焦点事件

-
会议会展

-
科技前沿
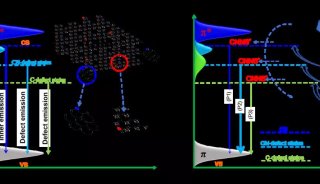
-
企业风采

-
焦点事件

-
项目成果

-
项目成果
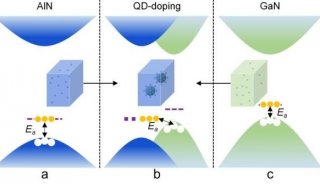
-
项目成果
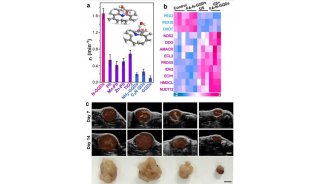
-
焦点事件

-
项目成果
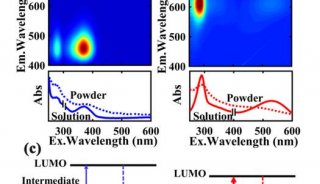
-
项目成果
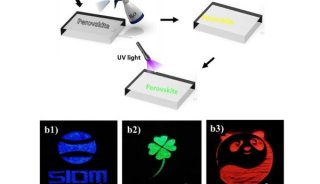
-
焦点事件
-
焦点事件

-
项目成果
-
项目成果
-
科技前沿

-
项目成果

-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
招标采购

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
企业风采

-
项目成果
-
项目成果
-
项目成果
-
项目成果

-
项目成果
-
科技前沿
-
项目成果
-
项目成果

-
焦点事件

-
科技前沿
-
项目成果

-
焦点事件

-
项目成果
-
焦点事件
-
科技前沿
-
科技前沿
-
科技前沿

-
科技前沿

-
项目成果
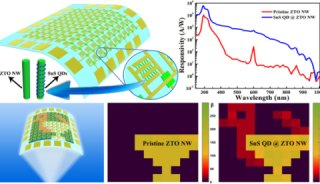
-
项目成果
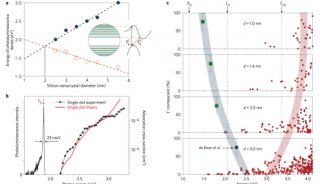
-
项目成果

-
科技前沿
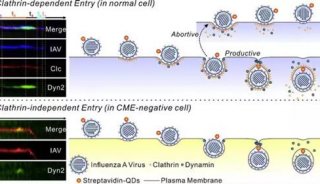
-
焦点事件

-
政策法规

-
项目成果

-
科技前沿

-
焦点事件

-
焦点事件

-
项目成果
-
科技前沿
-
会议会展

-
项目成果

-
科技前沿
-
科技前沿