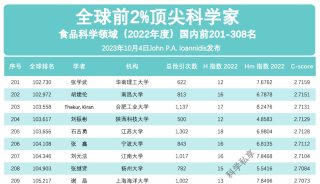
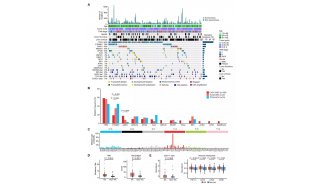
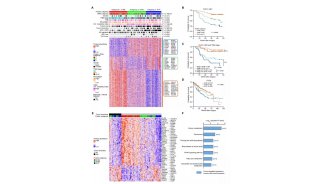
专访RNAi前沿科学家刘一
5月14日的《Nature》杂志以封面文章形式发表了德克萨斯大学西南医学中心刘一的一篇RNAi研究前沿文章,刘一教授发现了一类新的RNAi分子,qiRNA。人们对RNAi的了解又深入了一步。
为了让读者更进一步的了解qiRNA,生物通记者采访了文章的通讯作者刘一教授,百忙中的刘一教授爽快的接受了我们的采访。
目前,刘一任德克萨斯大学西南医学中心生理系教授,他的实验室主要从事生物昼夜节律分子机理与RNAi两方面的研究。
以下就qiRNA的问题采访刘一教授。
记者:您发现的这类qiRNA与我们常规的siRNA有什么样的区别?
刘一:脉孢菌的qiRNAs与siRNA在大小上不同,相比siRNA要小2-3nts,其产生机制和发挥的生物功能也与siRNA不一样。合成qiRNA,首先要以单链RNA(single-stranded RNA,ssRNA)为模板,这类模板被称为变体RNA(aberrant RNAs,aRNAs)。aRNA能被依赖于RNA的RNA聚合酶(RdRPs)特异性识别,在酶的作用下合成双链RNA(double stranded RNA,dsRNA)。然而,aRNA具体的合成过程以及如何被RdRPs识别,这些都是未知的。
记者:qiRNA的发现有什么重要的意义?
刘一:我们的研究小组的研究取得了两个重要的成果,我们首次发现了DNA损伤与RNAi路径的特殊关联。qiRNA的合成由DNA损伤诱导启动,DNA损伤会启动损伤应答,合成qiRNA抑制蛋白翻译。我们发现在DNA重组和转座子转座过程中自发性的DNA损伤会激发DNA重复序列产生多种小RNA(small RNA)。
其次,我们的研究成果对小RNA和aRNA的生物合成的研究具有重要的意义。在研究qiRNA的过程中,我们发现合成qiRNA首先需要有DNA损伤诱导的aRNA做模板。令人惊讶的是,常规的依赖DNA的RNA聚合酶(polⅠ,Ⅱ&Ⅲ)并不能用来转录aRNA,这表明aRNA的合成过程依赖一种新的依赖DNA的RNA聚合酶(DNA-dependent RNA polymerases,DdRP)。先前的研究认为,DdRP QDE-1是在aRNA合成后才发挥功能,而我们的研究发现QDE-1其实在aRNA的合成前期发挥重要的作用。并且,我们还发现QDE-1不仅是RdRP,还是一种依赖DNA的RNA聚合酶(DNA-dependent RNA polymerases,DdRP)。它首先用其DdRP的活性转录aRNA,接着用其RdRP的活性合成dsRNA。自aRNA被QDE-1合成后,其优先地被QDE-1识别合成dsRNA,我们的研究模型正好完美的解释了这一现象。
记者:以真菌为研究模型,所得出的结论能推及到高等生命吗?
刘一:其实,很多人都不知道脉孢菌其实是第一个用来研究RNAi的模型系统。实际上,RdRP QDE-1是最早鉴定的与RNAi有关的基因(1999)。此外,RecQ helicase QDE-3和Argonaute protein QDE-2紧接着就被发现了(分别在1999和2003年被发现)。显然的,脉孢菌是研究RNAi的生物模型,它具有遗传学和生化操作学方面的优势,我们用脉孢菌研究得出的结论对研究高等真核生物的RNAi机制具有重要的指导意义。
记者:在您的研究过程中,主要采用的技术有哪些?最关键的技术要点在哪?
刘一:我们主要用的还是常规的技术,不过,我们有将生化,分子生物学和遗传学技术有机地结合起来解决一些关键的问题。
记者:对于qiRNA,未来您的研究计划有哪些?
刘一:未来,我们将继续研究qiRNA的功能和发生机制。
记者:您能谈谈,RNAi领域未来研究的趋势吗?很多科学家都认为RNAi具有极其广阔的临床应用前景,您有什么看法,要走向临床,RNAi还有哪些困难要克服?
刘一:目前RNAi领域在集中研究Agarnaute binding small RNAs和它们的功能,其他小RNA和非编码RNA其实在诸多生物过程中起关键的作用,这是个巨大的课题,还有很多的结构功能以及调节机制没有被披露。
我认为,在未来RNAi将完全改变人们用药的方式,一旦找到完善的RNAi传递方式就可以完成这一梦想。在走向临床方面,主要的障碍在于治疗性RNAi的传递系统。只有克服这一难题才可能将RNAi技术应用于临床。
记者:RNAi领域可以说是一个迅速发展起来的学科,要保持走在前沿,您觉得对科学研究工作者有哪些要求?如何做到不断创新,突破?青年学子应该如何培养科学思维?
要走在前沿,我觉得需要不断地去发现了解重要的生物学问题,并且深入持久地挖掘生物学问题背后的机制。
不断创新突破的关键在于,保持问题驱动性(question- driven)的探索精神。
十分感谢刘一教授在百忙中抽空接受生物通的采访。
生物通报道,美国德克萨斯大学西南医学中心生理系,芬兰赫尔辛基大学生物科技学院生物与环境科学系以及西南医学中心细胞生物学系的研究者在最新一期的Nature上发表qiRNA is a new type of small interfering RNA induced by DNA damage文章,列为该期Nature杂志的封面文章。
文章通讯作者是华人科学家,德克萨斯大学西南医学中心生理系的刘一(Yi Liu,生物通译)教授,刘一实验室主要从事生物昼夜节律分子机理与RNAi两方面的研究。
RNA 干涉 (RNAi)是从真菌到人类都保留下来的一个基因沉默机制。在RNAi过程中siRNA和其他microRNA扮演重要的角色,它们直接调控基因的表达活性。要生成这些RNA(siRNA和microRNA)必须先合成一些变体的RNA(aberrant RNAs,aRNAs)或是前体RNAs(pre-RNAs),变体RNAs和前体RNAs能被依赖于RNA的RNA聚合酶识别,指导它们合成双链RNA。然而,aRNA的合成与识别机制一直不明。
刘一等人发现,在丝状真菌Neurospora crassa中,当DNA受到损伤时会诱导合成Argonaute蛋白QDE-2和一类新的小RNAs(Small RNAs),这类小RNAs能与QDE-2相互作用,由大约20-21个核苷酸组成(比脉孢菌的siRNA要少几个核苷酸),偏爱5‘端的尿核甙,大部分起源于核糖体DNA基因座上,因此被称为qiRNAs。
产生qiRNAs需有赖于RNA的RNA聚合酶QDE-1,the Werner and Bloom RecQ DNA helicase homologue QDE-3 以及 dicers参与。合成qiRNA的原料来自由DNA损伤所诱导产生的aRNAs,aRNAs作为qiRNA的前体,这一过程依赖于QDE-1与QDE-3。
研究结果表明,依赖于RNA的RNA聚合酶QDE-1是促进生成aRNA的酶。并且脉孢菌的RNAi突变常出现于DNA损伤情况下,这表明,RNAi对DNA损伤十分敏感,这也证明qiRNA是DNA损伤应答过程中的一环节,它能抑制细胞内错误蛋白的翻译,避免DNA损伤对细胞带来的伤害。
-
焦点事件

-
企业风采

-
焦点事件

-
精英视角

-
焦点事件

-
焦点事件

-
焦点事件

-
会议会展

-
项目成果
-
焦点事件

-
人物动向

-
焦点事件

-
焦点事件

-
精英视角

-
企业风采

-
精英视角

-
精英视角

-
焦点事件

-
精英视角

-
精英视角

-
项目成果
-
企业风采

-
科技前沿

-
企业风采

-
焦点事件
-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角

-
焦点事件

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
科技前沿

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
企业风采

-
焦点事件

-
科技前沿

-
科技前沿

-
科技前沿

-
项目成果

-
科技前沿

-
焦点事件

-
焦点事件

-
企业风采

-
项目成果

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿

-
焦点事件

-
科技前沿

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
科技前沿
-
科技前沿
-
科技前沿
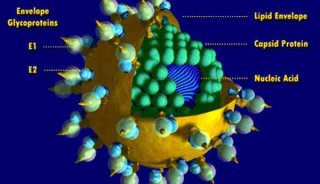
-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件

-
项目成果
-
企业风采

-
焦点事件
-
会议会展

-
科技前沿
-
焦点事件

-
会议会展

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
项目成果

-
项目成果

-
项目成果

-
焦点事件

-
项目成果

-
焦点事件

-
企业风采

-
企业风采

-
科技前沿
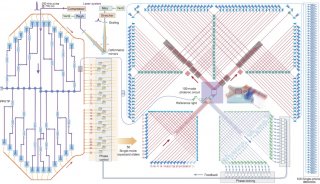
-
企业风采

-
焦点事件

-
焦点事件

-
科技前沿
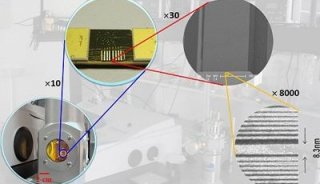
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
项目成果
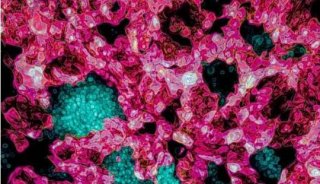
-
焦点事件

-
焦点事件

-
焦点事件

-
实验室动态

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
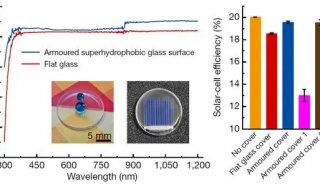
-
焦点事件

-
项目成果
-
焦点事件

-
项目成果
-
项目成果
-
项目成果

-
项目成果
-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
企业风采

-
焦点事件

-
企业风采

-
政策法规

-
科技前沿

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
项目成果
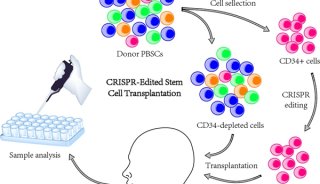
-
焦点事件

-
科技前沿

-
焦点事件

-
项目成果
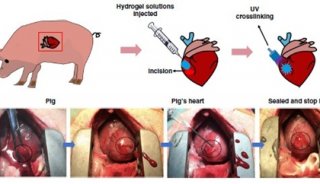
-
会议会展

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
精英视角

-
精英视角

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角
-
精英视角

-
企业风采

-
精英视角

-
焦点事件

-
会议会展