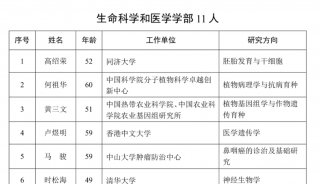
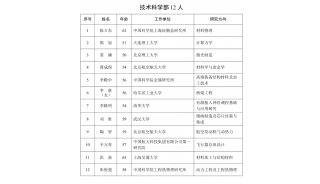
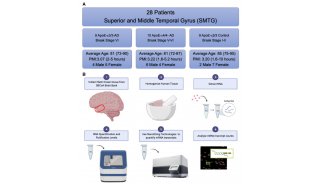
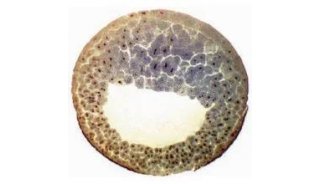
中国科学家培育出世界首个全面模拟人类AD的大鼠模型
阿尔茨海默病(AD)是老年期最常见的慢性疾病,以进行性记忆下降和认知功能减退为特征。AD不但严重影响了病人的生活质量,也给患者家庭和社会带来沉重负担。
AD的组织病理学变化主要是老年斑(SP)、神经元纤维缠结(NET),基于此,科学家已经提出了β淀粉样蛋白假说[1]和Tau蛋白异常磷酸化假说来解释发病机制。尽管在发病机制的研究方面取得了进展,但迄今为止,疾病治疗的研究几乎都没有取得成功。主要原因之一是缺乏能够全面模拟疾病的动物模型。
实际上,在过去的20年里,科学家已经开发了200多种AD动物模型。大多数AD模型是过度表达人类app(淀粉样前体蛋白)基因的转基因小鼠。这些模型虽然可以观察到Aβ蛋白的沉积,却没有出现其他AD病理特征,比如tau病理和神经元死亡。因此,如何开发能够全面模拟AD发病机制的模型,是研究人员急需解决的问题。
近日,来自清华大学药学院的鲁白和郭炜教授领衔团队在著名期刊Cell Research发表重要研究结果。
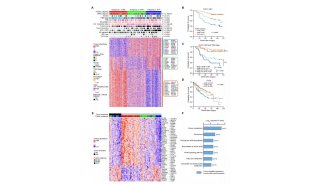
在这项研究中,他们使用CRISPR-Cas9基因编辑技术,用人源化且携带三个人类家族突变的App基因成功替换了大鼠同类基因,这就保证了app基因在大鼠体内的正常表达,而避免之前模型的过表达情况。让人惊喜的是,这个AD大鼠模型表现出类似于AD患者的病理和疾病进展,这在AD模型中尚属首次。
考虑到与小鼠相比,大鼠的生理行为特征更接近人类,鲁白和郭炜团队将大鼠作为改造对象。
他们先在NCBI中检索了大鼠和人类App基因的DNA序列,并分析了由App基因第16、17外显子编码的Aβ42肽序列。为了构建App基因敲入大鼠,他们将大鼠app基因的Aβ42的序列及其周围突变位点序列替换为人类序列。具体来讲,就是将Swedish突变(K670N和M671L)引入16号外显子,将Beyreuther/Iberian(I716F)和Arctic(E693G)突变引入到第17号外显子。
此外,为了实现Aβ序列的人源化,还引入了G676R、F681Y和R684H三个氨基酸的替换突变。
最后,他们使用CRISPR/Cas9基因敲入技术,获得纯合App敲入大鼠,命名为纯合AppNL-G-F。至此,他们成功将三个分布在app基因的两个外显子上的家系突变,同时准确无误地敲入大鼠基因组,并实现人源化,这是一项非常具有挑战性的工作[4]。
为了了解这个模型与以往转基因模型相比的优势,鲁白和郭炜团队从病理层面和行为层面对该AD模型进行了评估。
首先,AppNL-G-F大鼠确实避免了转基因技术中App过度表达的问题。App转基因小鼠最大的缺陷是App蛋白表达水平比正常水平高得多,这会扰乱小鼠的正常生理功能。因此,很难判断在动物中观察到的突触和行为缺陷,是由于Aβ蛋白的沉积,还是由于非生理性表达的App及其代谢物。而嵌合App基因的表达由大鼠内源启动子驱动,保留了app及其代谢物的内源水平。
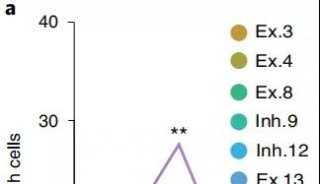
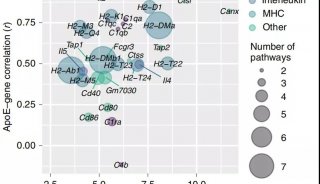
其次,模型显示了全面的Aβ病理学特征。appNL-G-F大鼠小脑中存在着丰富的Aβ寡聚体和斑块,它们在小脑中的空间分布也与人类AD大脑中的淀粉样病变相似。
鲁白和郭炜团队还观察到类似于人类的Tau蛋白异常磷酸化形成神经元纤维缠结(NET)。tau蛋白病理性聚集而形成的神经原纤维缠结是AD的另一个标志,而迄今为止报告的App突变小鼠模型都没有表现出tau病理学。这显示了appNL-G-F大鼠模型的另一优越性。
此外,这个大鼠模型还表现出由细胞凋亡和坏死性凋亡介导的神经元死亡,以及大脑皮层的严重萎缩,从MRI图像上可以观察到脑室扩大。而无论是转基因的“一代小鼠模型”[5],还是基因敲入的“二代小鼠模型”[6],都没有出现神经元的死亡或脑萎缩。
在行为层面上,鲁白和郭炜团队测试了AppNL-G-F大鼠的空间学习记忆功能和情景记忆功能。无运动功能障碍的AD大鼠在Morris水迷宫 (MWM) 测试中显示出空间认知缺陷,无视觉功能障碍的AD大鼠在触摸屏操作测试中显示情景认知缺陷。这些实验表明appNL-G-F大鼠的空间学习记忆以及情景记忆均受损。
除此之外,鲁白和郭炜团队在评估模型的过程中还发现:appNL-G-F大鼠的病理变化(Aβ沉积、神经胶质增生、tau病理、突触变性、认知缺陷)发生的时间顺序,都与AD患者相似;而且,tau病理总是出现在Aβ沉积之后,这似乎提示着Aβ沉积与tau病理之间存在着因果关系。这些发现为继续深入研究AD发病机制提供了方向。
更有趣的是,雌性AppNL-G-F大鼠表现出比雄性更具侵袭性的Aβ病理进展,这与在人类中观察到的非常相似:大约三分之二的AD患者是女性。这提示着appNL-G-F模型在揭示AD发病性别差异的潜在机制中可能发挥作用。
-
科技前沿
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
科技前沿

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
政策法规

-
焦点事件

-
企业风采

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
产品技术

-
科技前沿

-
项目成果

-
标准

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
标准

-
项目成果
-
焦点事件

-
精英视角

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
会议会展

-
焦点事件

-
会议会展

-
科技前沿

-
焦点事件

-
综述
-
标准

-
科技前沿
-
企业风采

-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角

-
企业风采

-
焦点事件
-
精英视角

-
焦点事件
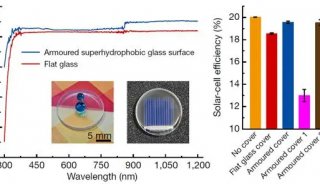
-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
焦点事件

-
项目成果

-
项目成果
-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件
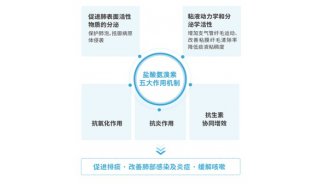
-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件
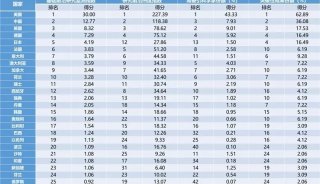
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
项目成果
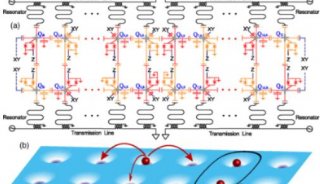
-
项目成果
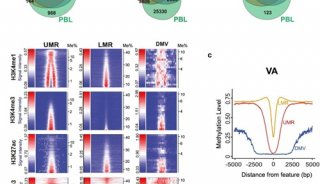
-
焦点事件

-
项目成果

-
焦点事件

-
项目成果
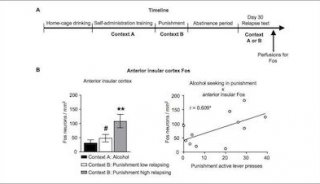
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果