辉瑞接连失利,“减肥市场”这块蛋糕谁吃到了?
继今年6月终止GLP-1类药物Lotiglipron的开发后,近日,辉瑞宣布再终止一款减肥药——Danuglipron每日两次给药频率项目的开发。
此前已终止一款减肥药的开发
辉瑞布局的口服GLP-1类药物包括Lotiglipron和Danuglipron等,其中Lotiglipron每天只需口服一次,而后者需要每天口服两次。此前公布的临床数据显示:
接受每日一次Lotiglipron治疗的2型糖尿病患者,6周后空腹血糖水平显著下降,接近正常水平的阈值。同时,Lotiglipron剂量依赖性降低2型糖尿病和肥胖患者的体重,在治疗4-6周后,最高剂量组患者平均减重约10斤。
接受Danuglipron治疗16周之后,所有剂量组2型糖尿病患者的糖化血红蛋白(HbA1c)水平与安慰剂相比均显著降低。同时,最高的两个剂量组(80 mg每日两次和120 mg每日两次),患者减重效果显著,平均减重近10斤。
基于Lotiglipron每日只需服用一次的便利性,辉瑞曾表示在所有条件相同的情况下,更倾向于推出Lotiglipron。但今年6月,辉瑞宣布“基于Lotiglipron在1期临床试验中的药代动力学数据,以及在二期临床试验中转氨酶升高(判断肝细胞受损的敏感项)的测量结果”,终止Lotiglipron的临床研究,后续将继续推进同类候选药物Danuglipron的开发。
又一款失利
彼时,辉瑞官网信息显示,在参加Danuglipron试验的患者中尚未发现转氨酶升高的问题,Danuglipron的中期试验已完成全部参与者入组,预期到2023年底能够完成最终试验阶段的计划,后续将在此基础上开发每日一次给药版本。

但目前,Danuglipron的研发出现意外。
二期试验中,600多名肥胖成人接受了不同剂量的Danuglipron治疗。数据显示,Danuglipron治疗26周减重5%-9.5%,治疗32周减重8%-13%,而服用安慰剂的患者,26周时体重增加0.17%,32周时体重增加1.4%,研究达到了中期减肥试验的主终点,但不良事件发生率很高,辉瑞表示,试验中高达73%的患者出现恶心、47%的患者出现呕吐、25%的患者出现腹泻。该试验Danuglipron所有剂型的停药率均超过50%(较高的停药率基本上意味着药物有显著的副作用,导致患者无法继续服用),同时,安慰剂组的停药率为40%。
基于以上,辉瑞宣布将放弃Danuglipron每日两次给药频率项目的开发,未来将集中在每日服用一次的Danuglipron制剂的开发,该产品正处于I期研究阶段,相关数据将在2024年上半年公布。辉瑞首席科学官Mikael Dolsten在一份声明中表示:“我们相信,改进后的每日一次的Danuglipron可以在肥胖治疗中发挥重要作用。”
减肥药市场竞争激烈
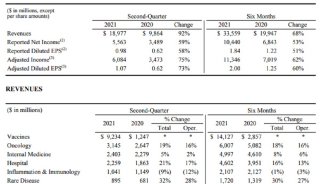
在口服减肥药领域,诺和诺德、礼来、辉瑞是最头部的竞争者。目前,诺和诺德的Wegovy(注射用减重药)已获得美国FDA批准上市,其2023年前三季度业绩报显示,Wegovy销售业绩达217.29亿丹麦克朗(约合31.57亿美元、225.5亿人民币),同比增长481%。
礼来方面,今年11月,其GLP-1R/GIPR双重激动剂Tirzepatide获FDA批准用于减重,该药也是首款获批同时激活两种肠道激素受体(GIP和GLP-1)的药物。2023年前三季度,Tirzepatide为礼来贡献了29.58亿美元的销售额,而这只是该药仅获批降糖适应症的情况下实现的销量。此外,Tirzepatide用于减重的适应症申请也已在中国提交。
有分析人士认为,基于辉瑞目前在减重领域接连的失利,该公司已经进一步的落后于减肥药市场的主导者诺和诺德和礼来。
除了三大头部竞争者,其他企业也在纷纷布局减重赛道。今年11月9日,阿斯利康与中国生物制药公司诚益生物(Eccogene)就每日口服一次的GLP-1受体激动剂ECC5004达成独家许可协议,获得在中国以外所有国家和地区所有适应症的开发和商业化ECC5004独家权益。根据协议条款,诚益生物将获得1.85亿美元的首期预付款,还将获得高达18.25亿美元的临床、监管和商业里程碑奖励,以及产品净销售额的分层收入。资料显示,I期试验的初步结果显示,与安慰剂相比,ECC5004具有良好的耐受性,并且在测试的剂量水平上促进血糖和体重的降低。
12月4日罗氏宣布已经和手握三款GLP-1管线的Carmot Therapeutics达成最终合并协议,根据协议条款,罗氏将在交易结束时向 Carmot 的股东支付 27 亿美元的现金;此外,根据某些里程碑的实现情况,Carmot 的股东有权获得高达 4 亿美元的付款。资料显示,Carmot的三款产品分别是:一种是每周一次皮下注射GLP-1/GIP双重受体激动剂CT-388、每天一次皮下注射GLP-1/GIP双重受体激动剂CT868、一天一次口服小分子GLP-1激动剂CT-996。目前前两款产品已进入二期临床阶段,安全性和耐受性良好。
-
焦点事件
-
投融资

-
焦点事件

-
焦点事件

-
企业风采

-
企业风采

-
市场商机

-
焦点事件

-
市场商机

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
财报

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
企业风采
-
科技前沿
-
科技前沿

-
科技前沿

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
项目成果
-
项目成果

-
焦点事件

-
焦点事件

-
项目成果
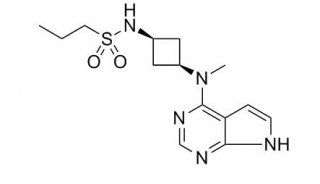
-
项目成果

-
焦点事件
-
焦点事件
-
焦点事件

-
焦点事件
-
产品技术
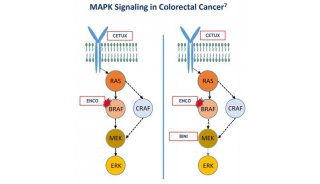
-
焦点事件

-
并购

-
市场商机

-
市场商机

-
焦点事件

-
焦点事件

-
项目成果

-
科技前沿

-
焦点事件

-
产品技术

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件