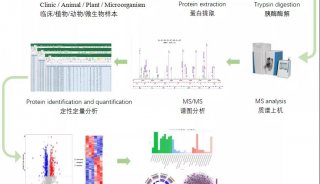
亚细胞蛋白质组学,打开新领域的大门!
随着人类基因组计划 (HGP )的提前完成,生命科学已进入后基因组和蛋白质组时代。后基因组研究以完全解说和阐明基因序列的功能和作用为主要目标,其研究的内容包括功能基因组学和蛋白质组学。前者主要在基因水平认识细胞的生理病理变化,后者则通过分析比较不同生理病理条件下细胞或组织中表达的蛋白质或区域细胞器亚单位蛋白质的异同,以揭示生命现象中起关键作用的蛋白质分子。小鹿根据查阅的相关文献资料整理总结了亚细胞蛋白质组学研究的意义和进展,希望对各位科研人员有所帮助。
蛋白质组 (proteome)是由澳大利亚学者wilns和williams等于1994 年提出的,指的是由基因组编码的全部蛋白质。蛋白质组学 (proteom ics)是利用生化方法对所有蛋白质进行大规模的研究,包括对基因产物的功能分析,如大规模的蛋白质鉴定、定量、定位 、修饰 、功能、结构 、调节和活性的研究,还包括蛋白相互作用的研究。
亚细胞蛋白质组,是亚细胞结构如亚细胞区室内、特定蛋白质组分、细胞器等所包含的所有蛋白质。细胞内成分根据空间结构、分布及功能的不同,分成不同的细胞器或细胞区域,如细胞膜、胞浆、线粒体、溶酶体、过氧化物酶体、内质网、细胞核和高尔基体等;另外,细胞器内一些功能单位多是大分子结构或蛋白质复合体,如核基质、剪接体、纺锤体、核孔结构 、以及核糖体等。对这些亚细胞结构蛋白质组学研究可以更好地理解全细胞蛋白质组。
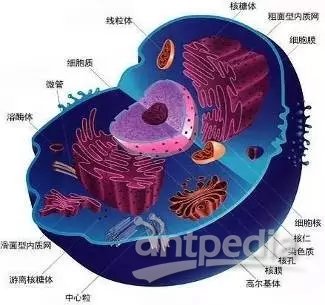
一 . 亚细胞蛋白质组学研究的意义
构成生物体的组织和细胞结构复杂,其内的蛋白质组成种类繁多、性质多样、丰度差异大,常规方法不能够分离组织和细胞内的全部蛋白质,而利用蛋白质组学技术分离则会丢失大量的蛋白质信号。因此,以亚细胞分级和蛋白质组学的融合而诞生的亚细胞蛋白质学在细胞生物学和分子生物学的研究中有着更深远的意义。
1. 富集低丰度蛋白,完善全细胞蛋白质组
由于全细胞表达的蛋白质种类繁多,直接进行全细胞的蛋白质组学分析,会受到上样量、细胞内蛋白质拷贝数的巨大差异及蛋白质组学技术本身的限制,难以分离、鉴定出全部蛋白质,尤其是低丰度蛋白。但是,各种蛋白质在细胞内有一定的空间分布,各种亚细胞组分也有各自特征性的蛋白质种类组成。因此,分离亚细胞组分可以减少蛋白质的种类,富集低丰度蛋白,有望分离和鉴定出更多的新蛋白和新基因,以便了解这些低丰度蛋白的功能。
2. 加深对亚细胞组分结构和功能的理解
对特定亚细胞组分的所有蛋白质组成的了解,非常有利于针对该结构功能单位的特定研究。Rout等从分离出的酵母核孔复合体 (nuclear porecom plex,NPC )组分中鉴定出 174 种蛋白质,并证明其中40种蛋白质与核孔复合体有关,这对核孔复合体的结构模式与功能研究有积极意义。
3. 亚细胞蛋白质的差异表达谱
病理情况下,不同亚细胞组分受影响的程度不同。因此,亚细胞蛋白质组学研究将更灵敏的反映病理因素造成的一些蛋白质的量变、质变和蛋白的迁移情况,对一些特别受影响的细胞器的病理情况,亚细胞蛋白质组研究就更有意义。
二、亚细胞蛋白质组研究进展
随着多物种基因组计划的实施,在后基因组时代对基因序列表达产物的功能分析将变得日益重要。蛋白质的亚细胞定位对蛋白质生物功能的发挥有着极其重要的作用,且蛋白质亚细胞定位信息可以暗示其生物学功能。由于蛋白质亚细胞分级技术根据理化性质的不同分离出各种亚细胞组分,可以极大地降低针对全细胞蛋白质组学研究的复杂性。而且,对亚细胞组分所有蛋白质的鉴定,一方面可以明确各种亚细胞组分的蛋白质组成 ;另一方面可以获得相应蛋白质的亚细胞定位信息。此外,对新蛋白质亚细胞定位信息的了解还可以促进对其生物功能的认识,这使得亚细胞蛋白质组学的研究日益成为蛋白质组学研究的热点。
1. 线粒体蛋白质组学研究进展
线粒体作为细胞的产能中心、代谢中心和凋亡中心,在生命过程中发挥着重要的生理功能;且生物体疾病的发生往往会引起线粒体蛋白质结构与功能的变化,因此,线粒体蛋白质的研究日益受到关注,而蛋白质组研究技术的产生与发展为线粒体蛋白质组的研究提供了有力的支持,使得从整体上研究线粒体蛋白质组在生理、病理过程中的变化成为可能。Rabilloud等以健康人的胎盘作为组织来源,分离提取线粒体进行蛋白质组研究 ,他们使用 IPG(pH 4.0~8.0)双相电泳技术,共获得1500个蛋白点,通过 MALDI-TOF-MS 和 PMF等技术鉴定其中的一些蛋白点,鉴于当时基因组信息的局限性,只有46种蛋白被鉴定出来,初步建立线粒体蛋白质组数据库,为研究遗传性或获得性线粒体功能障碍时线粒体蛋白质的变化提供依据。
2. 高尔基体蛋白质组学研究进展
高尔基体(golgi body)又称高尔基器 (golgi ap—paratus)或高尔基复合体 (golgi com plex ),是 普遍存在于真核生物体内的一种细胞器。高尔基体是真核细胞内大分子运输的一个主要的交通枢纽,主要参与细胞分泌,是糖的合成和蛋白质翻译后修饰的主要场所。近年来,高尔基体蛋白质组学研究已获得大鼠高尔基体及其不同组织的 2-D E 图谱 ,质谱鉴定出百余种蛋白质包括新蛋白 G PP 34、G M x33 等。不同功能状态高尔基体比较蛋白质组学研究揭开了部分蛋白质的表达上调现象,并且随着分离技术和纯化蛋白技术的发展,对不同生物体及不同生理、病理状态高尔基体的蛋白质组学研究将会进一步促进对高尔基体结构和功能的认识。
3. 细胞核蛋白质组学研究概况
细胞核是真核细胞最大最重要的细胞器,是进行DNA复制 、转录和转录初产物的加工场所,是细胞遗传和代谢的调控中心。因此 ,对细胞核蛋白的研究有助于更进一步了解细胞核的结构与功能。
3.1 核膜蛋白质组学研究进展概况
细胞核由于相对容易纯化和对细胞生命活动的重要性,其蛋白质组研究较早。因为细胞核包含几个明确的结构和功能区 (即亚核结构),所以对细胞核的蛋白质组学分析主要集中在这些亚核结构上。核膜主要负责核内外物质和信息的交换,尤其是在蛋白的输入和 RNA 的运出中发挥重要作用。Schirmer等[3]通过 MudTIP对来自肝脏的核膜蛋白进行了分析与鉴定 ,由于核膜包括三个组成部分,核外膜、核内膜和核孔复合体 ,其中部分外膜在结构上与粗面内质网相连,导致核膜在分离中易有内质网的污染,另外线粒体污染也常常伴随其中。因此,他们引入了差减蛋白质组学方法,分别纯化鉴定核膜 (NE )和微粒体膜 (MM )的蛋白质组成,并且将NE中鉴定到 的蛋白质减去MM 中鉴定到的蛋白质 ,从而去除了内质网和线粒体污染蛋白,得到了可能的细胞核膜蛋白。运用这种方法,他们共鉴定出了80 个候选核膜蛋白质 ,其中已知的13 种核膜蛋白质全部得到鉴定,另外的 67 种为新的核膜蛋 白质。此外,他们还从 67 种新的核蛋白中选取8种做了免疫定位实验,结果均具有核膜定 位 ,剩余的 59 种蛋白质还需进一步的定位和功能分析,但通过染色体定位分析发现有 23 种蛋白质与疾病相关。因此 ,Schirmer等指出,对这 67 种新蛋白的研究将有助于对核膜功能的全面阐述。
3.2 核仁蛋白质组学研究进展
Andersen等研究报道 ,核仁可能执行除涉及核糖体外的其他细胞器的功能,他们采用质谱和数据库搜索方法,鉴定了 271 种蛋白质,数据表明核仁的蛋白质组成不是静态而是随着细胞代谢状态的改变而改变的。Scherl等对人类核仁的功能蛋白质组进行分析 ,共鉴定出了 213 种核仁蛋白。最近 ,Andersen等运用质谱技术和稳定同位素标记建立了一种研究细胞器中蛋白质动态变化的定量蛋白质组学方法,即在三种影响核仁形态的不同代谢抑制剂的作用下,运用质谱技术和稳定同位素标记检测到了 489 种核仁蛋白质的改变。有稳定的相互作用的蛋白质,如R N A 聚合酶Ⅰ亚基和小的核糖体蛋白质颗粒复合物,在离开核仁或聚集核仁时有着相同的变化趋势;而无稳定相互作用的蛋白质,如核糖体的大小、亚基的蛋白成分,其动态趋势差别显著。从而证明了核仁蛋白质组在不同的生理状态随着时间的变化有着很明显的改变,进一步推断出无论是核仁还是其他细胞器的蛋白质组都不是唯一的、完整的,而是在不同生理状态下彼此有交迭。
3.3 核孔复合体蛋白质组学研究进展
核孔复合体(nuclear pore com plex,N PC )位于内外核膜彼此融合的区域,是真核细胞核物质交换的唯一通路。Rout等[5]运用将不同的缓冲液体系和蔗糖密度梯度离心的方法 。分离纯化富集到的酵母核孔复合体蛋白,经M S分析 、搜索 N R 蛋白质库 ,共鉴定出174 种基 因产物,其中34种对应于未知ORF.Cron—shaw 等。对哺乳动物大鼠核孔复合体进行了蛋白质组学研究,鉴定出 94 种基因产物 ,根据文献以及数据库中信息分为 23 个核孔蛋白,18 个核孔复合体相关蛋 白,42 个非核孔复合体蛋白,11个功能未知蛋白,免疫荧光定位实验证明其中6个功能未知蛋白质定位于核孔复合体。
4. 内质网蛋白质组研究进展
Knoblach等运用双向电泳和MALDI—TOF方法 ,鉴定了 141 种小鼠内质网蛋白质,其中 6 种是新蛋白质,包括ERp l9 和ERp46.氨基酸序列分析说明 ERp l9 和 ERp46 分别含有一个和三个硫氧还原序列基序 ,提示它们是硫氧还原蛋 白家族 的新成员。为了验证 ERp l9 和ERp46是否具有二硫化物异构酶(PD I)功能,他们用酵母 互补功能实验进行了验证 ,结果证明了ERp46具有二硫化物异构酶的功能,而ERp l9没有该功能。
5. 大分子复合物蛋白质组学研究进展
亚细胞蛋白质组研究除涉及到几乎所有细胞器外,对细胞内的大分子结构,如中间体、中心体也有重要的进展。Andersen等运用 SDS-PAGE结合串联质谱方法对中心体进行了研究,为了确证真正位于中心体的蛋白,他们采取蛋白质校正谱图分析法(PCP)找到了137 种可 能的中心体组分,用免疫荧光的方法验证了 23 种新的中心体蛋白质。同时,还找到了一些与疾病相关的蛋白质,如与人的失调症相关的A I M S1蛋白。中间体是一种在细胞分裂期 出现的结构 ,来自中心纺锤体 ,出现在两个子代细胞即将分裂前的连接处。同中心体一样,人们对中间体的了解也很少,但是推测其组成成分参与细胞的有丝分裂。Skop等对哺乳动物中间体蛋白质进行了组学研究,鉴定到了 160 种候选中间体蛋白质,运用免疫荧光实验验证了10 个新蛋白定位于中间体上。为了验证这些蛋白质是否参与细胞的有丝分裂 ,他们运用RNA干涉实验对其进行验证,结果证明80种蛋白质与有丝分裂相关,还发现内质网蛋白质GRP94 在染色体的分离中起重要作用。
尽管亚细胞蛋白质组学研究已取得了很大的进步,但还存在着诸多的挑战,首先是低丰度蛋白的鉴定,其次是确认鉴定出的蛋白质的真实亚细胞定位。因此,用各种物理的、化学的或生物的办法都很难提取分离到高纯度的亚细胞结构,导致最后鉴定出来的蛋白质不能直接确定就是定位于所提取的亚细胞结构,因为有相当的蛋白质就是其他细胞结构的污染,当然也不能排除某些蛋白质就是多定位的或在不同的生理或物理条件下定位发生变化,不能简单的认为就是其他细胞结构的污染,否则会丧失重要生理现象发现的机会,对于是否是污染还是发生定位变化则尚缺乏研究。所以,今后亚细胞蛋白质组学有很大的发展空间,它能更多的鉴定蛋白质,更重要的是阐述这些蛋白的定位或功能,在这种细胞结构中发挥怎样的作用,解释鉴定出来的蛋白质是来自于其他亚细胞结构还是发生了定位变化,并以此来阐明这些蛋白质在整个细胞活动中的作用。此外,将亚细胞蛋白质组用于比较蛋白质组学可能会成为一个新的发展方向,因为整个细胞的蛋白质组很复杂,分析亚细胞结构蛋白质组可以降低复杂度,可能会使一些相对低丰度的蛋白质得到呈现,而且可以提示亚细胞定位和功能信息,从而发现更多的可能更有意义的差异蛋白质。
上海鹿明生物科技有限公司、武汉鹿明生物科技有限公司、上海博苑生物科技有限公司是鹿明集团成员企业,专注于生命科学和生物技术领域,主要从事以蛋白质组和代谢组为基础的,包含生物信息学分析在内的系统生物学技术服务与合作研究。此外,公司还拓展了专业培训、学术会议承办、系统生物学相关试剂耗材。公司成立7年来,已建立近千平米的系统生物学独立实验室,拥有ABI-5600-Triple-TOFLC-MSMS、Thermo-QExtractiveLC-MSMS、Agilent7890 GC-MS等大型仪器。目前,与鹿明集团合作过的国内外客户已逾2000位,涉及医学、农业、生态学及工业应用等多个研究领域,发表SCI论文500多篇,充分展现本团队在组学领域的专业能力。
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
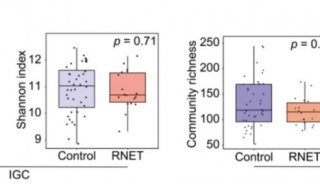
-
厂商文章
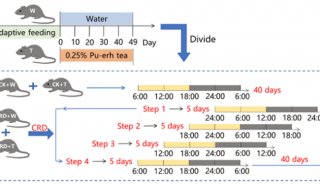
-
厂商文章
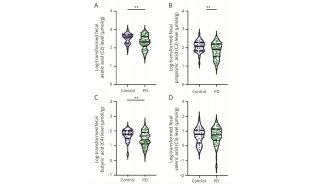
-
厂商文章
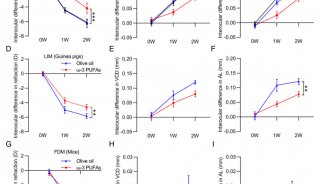
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
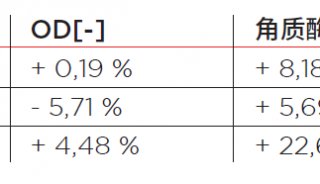
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
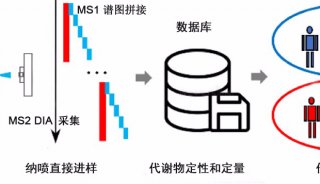
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
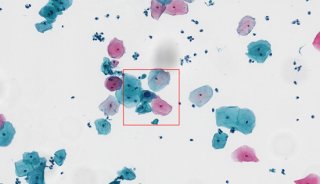
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
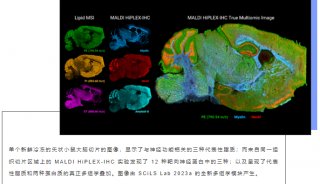
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
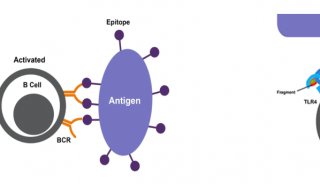
-
厂商文章

-
厂商文章
-
厂商文章
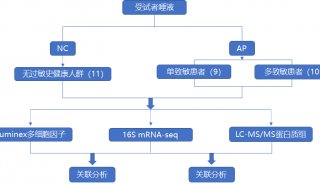
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
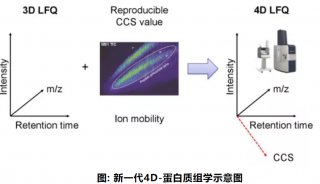
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
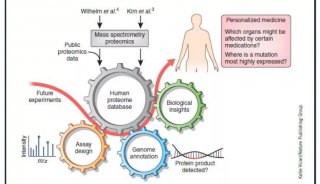
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
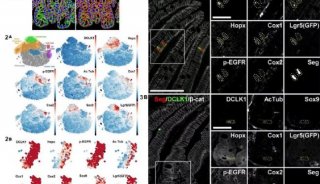
-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
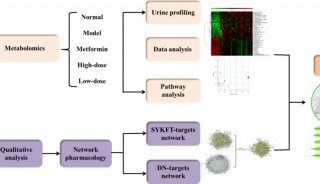
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
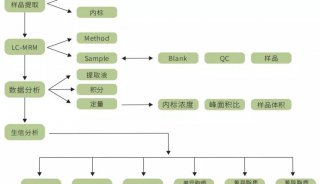
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
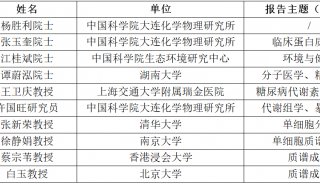
-
厂商文章
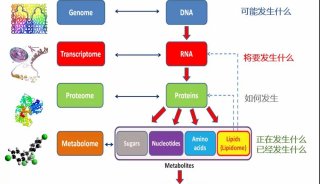
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
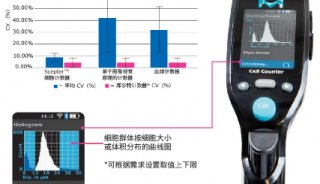
-
厂商文章
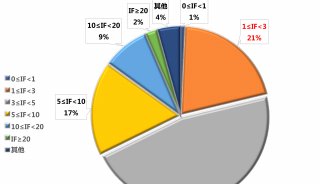
-
厂商文章
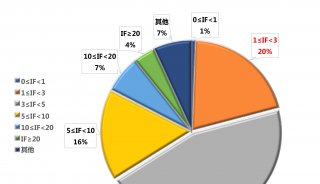
-
厂商文章

-
厂商文章
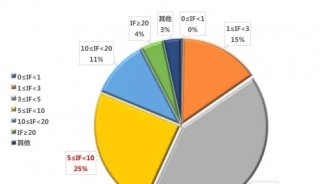
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
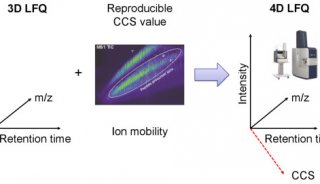
-
厂商文章

-
厂商文章
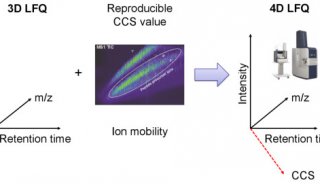
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
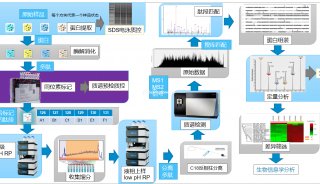
-
厂商文章
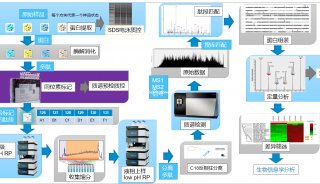
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
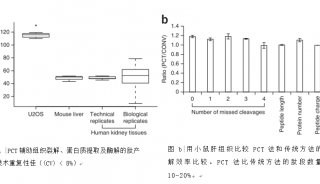
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
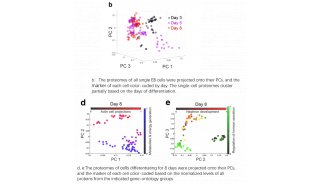
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
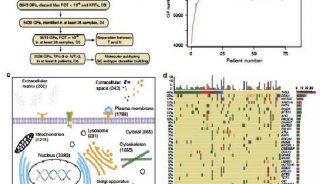
-
厂商文章
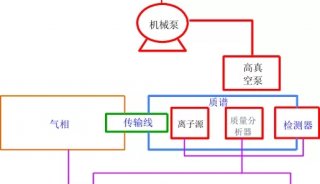
-
厂商文章
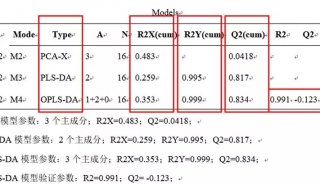
-
厂商文章

-
厂商文章
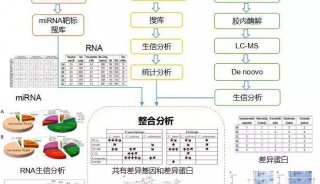
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
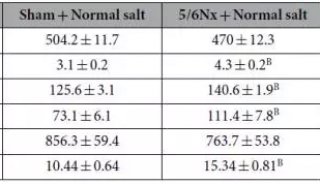
-
厂商文章

-
厂商文章
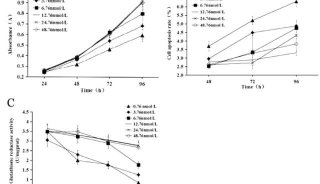
-
厂商文章

-
厂商文章
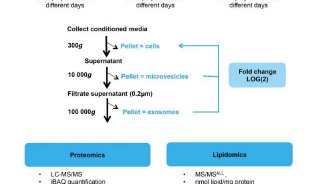
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章








