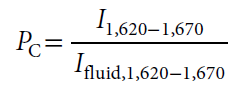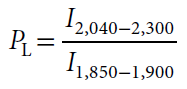自动化拉曼光谱仪用于活细胞功能分类(一)
自动化拉曼光谱仪可以在单细胞层面进行功能分析,筛选对某种物质具有代谢活性的细胞用于后续分析,使得微生物生态的研究更加具有针对性和精确性。
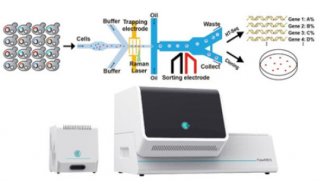
2019年3月《Nature microbiology》期刊上,“自动化拉曼光谱仪用于活细胞功能分类”介绍了一个微流控光学平台结合了微流体、光镊和拉曼光谱技术,用于对稳定同位素标记的微生物细胞进行自动化分类,可以产生适合后续单细胞基因组学、微型宏基因组学以及纯培养的活细胞。
An automated Raman-based platform for the sorting of live cells by functional properties
自动化拉曼光谱仪用于活细胞功能分类
作者:Kang Soo Lee, Márton Palatinszky, Fátima C. Pereira et aI.
期刊:Nature Microbiology (IF=14)
时间:18 March 2019
文章摘要
本文描述了这个基于拉曼光谱的细胞分类技术的设计与优化,并举例操作了四个模式细菌(包括2个肠道、1个土壤和1个海洋),展示了这项技术高的分类精度(98.3 ± 1.7%)、高的通量(200–500细胞每小时、3.3–8.3细胞每分钟)以及培养的兼容性。使用这项技术用于细菌宏基因组分析研究小鼠结肠粘蛋白降解,结果显示多种细菌(包括Muribaculaceae科的一些物种)参与其中,突出了这个生态位的复杂性以及拉曼光谱细胞分选用于鉴别所研究生态过程中关键物种的潜力。
研究背景
环境以及宿主关联的微生物组研究旨在了解复杂微生物群落的组成及功能。单细胞研究越来越重要,因为其可以提供系统发育和基因组多样性、表型和微环境的异质性、微生物与宿主及病毒之间关联的信息。通过在微生物群落中添加同位素标记的化合物,生理的原位分析也可以在单细胞水平实现。微生物细胞可以消耗这些化合物并整合到自己的生物量中,这时候可以通过自动射线照相技术、纳米级二次离子质谱或显微拉曼光谱技术来追踪这些同位素。为了鉴定消耗这些化合物的细胞,这三种技术可以和荧光原位杂交结合在一起使用。
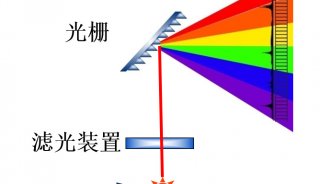
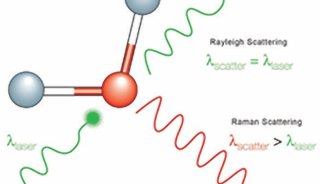
理论上,微生物学家可以对复杂微生物群落中的单个细胞进行功能分析,并直接获取那些具有所研究功能的细胞的基因组。然而目前所有的单细胞基因组研究中,单个细胞是随机抽取的或者根据某些遗传特征使用PCR、荧光原位杂交抽取。最近有两种方法可以基于代谢活性选择微生物细胞进行全基因组扩增与测序,一是通过生物转录翻译带荧光标记的氨基酸序列标签然后进行荧光激活细胞分选(FACS);另一种是通过使用重水培养用稳定同位素氘进行标记,含氘的细胞可以使用拉曼光谱C-D指纹区域(2,040–2,300cm−1)进行鉴别。这种方法具有无破坏性、无需固定细胞、可以检测样品中所有代谢活性细胞的优点。使用这种方法,可以检测当某种特殊化合物出现时具有活性的细胞,而这种化合物自身不需要标记。我们可以在毛细管中检测拉曼光谱,并将氘标记的细胞通过光镊进行分离。
本文介绍了一个全自动化的微流控平台用于激活拉曼光谱的微生物细胞筛选,该平台具有较高的通量,可以基于功能对细胞进行分选从而用于后续的培养、微宏基因组以及单细胞基因组分析。与以前的技术相比,该平台不需要细胞含有能增强拉曼光谱检测敏感度的化合物例如胡萝卜素,从而可以适用于更大范围的细菌、古菌以及所有的真核细胞。
结果讨论1微流体分选、3D聚焦与系统配置
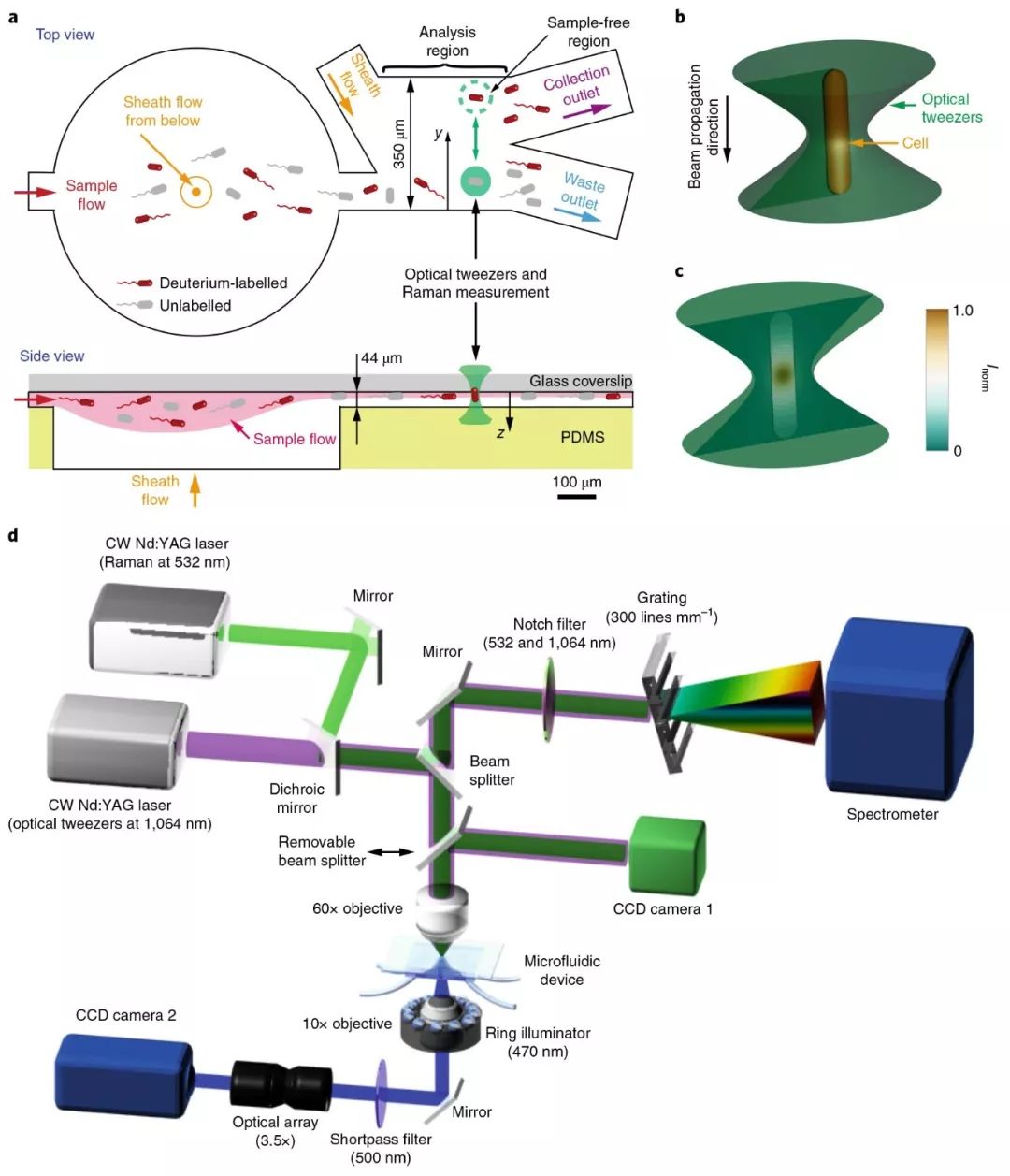
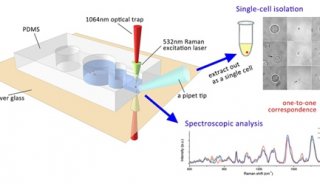
RACS平台使用微流控装置来捕获与移动微生物细胞,用于后续的拉曼光谱测量与细胞分选。此装置依赖于三维微流道技术来控制样品流在聚二甲基硅氧烷(PDMS)微流体分选器中的位置。如图1a所示,首先使用垂向鞘流将水平流动的样品聚集到玻璃盖玻片附近,从而保证光镊较高的捕获率并使用鞘液将样品与PDMS隔开防止其对拉曼光谱的干扰(注sheath flow:微流控中的鞘流技术,在细胞计数中为了避免细胞从小孔边缘处流过及湍流、涡流的影响,用毛细管对准小孔管,细胞混悬液从毛细管喷出。同时与四周流出的鞘液一起流过敏感区,保证细胞混悬液在中间形成单个排列的细胞流,四周被鞘液围绕),实际效果如下面视频1所示。而之所以使用玻璃而不是石英的盖玻片,是为了防止在光谱检测区的干扰(排列规则的晶体拉曼光谱更强)。在水平向样品流的下游,设置另一处鞘流,使得细胞在默认情况下流向废液流出口(实际效果如视频2所示)。
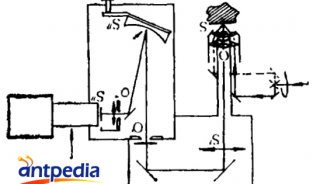
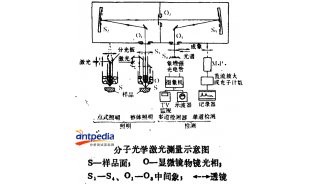
RACS平台的核心是一台商用的共聚焦拉曼显微镜。在RACS平台运行过程中,首先使用CCD相机1对两束激光进行聚焦,之后分光镜(注beam splitter:分光镜,就是部分反射部分透射的介质,一般是半反射半透射的,通过镀膜控制反射透射的比例)被移除,之后拉曼显微镜开始进行操作。细胞的捕获、运输和释放过程通过CCD相机2来监测,拉曼显微镜的载物台可以移动从而实现盖玻片下方10μm处的聚焦点可以进行分选。
图1. RACS平台的设计与工作原理(a. 样品流中的细胞水平进入微流控装置,并通过垂向和水平向的两个鞘流进行控制,使其单个排列流过,默认情况下流向废液出口,绿色圆圈中被光镊捕捉的细胞移动到远离样品的鞘流区进行拉曼光谱测量,检测到的标记细胞被释放到收集出口,而未被标记的细胞则带回样品流释放到废液出口 b. 微生物细胞被限制在光镊中 c. 归一化的细胞中拉曼光谱信号分布 d. 整个平台配置流程图,拉曼测量光源和光镊光源由激光器产生并通过60倍物镜被聚焦到微流控装置的同一位置,CCD相机1用来激光校对,之后可移动的分光镜去除,在检测中携带散射光的混合光被导向波谱分析仪用于拉曼光谱分析,过程中使用过滤器过滤掉激光光源的光,微流控装置下方有环形光源,以帮助CCD相机2实时监控细胞分选过程)
2
氘标记细胞的检测分析
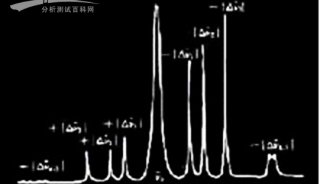
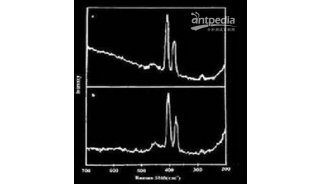
对于单个细胞,如果检测到可靠的拉曼光谱标准证明其含有氘,那么便将其释放到收集出口而非废液出口。本文使用三个革兰氏阴性(两个肠道的一个海洋环境)与一个革兰氏阳性(土壤环境)细菌物种(Escherichia coli,Salmonella typhimurium,Marinobacteradhaerens和Bacillus subtilis)为例,通过波长1620-1670 cm−1之间的拉曼光谱信号的增强来判断细胞出现在光镊之中(如图3a所示),因为这一区域不受PDMS和玻璃的影响,因此细胞指数可以通过有细胞存在时的信号与空白对照的比值来计算:
使用CCD相机2进行观测发现光镊中出现细胞总会有PC>1.0(无论是否氘标记),且含有氘标记的PC值稍低于未标记细胞,四个物种的PC值对比如图3c所示,根据评估选用PC>1.7(PC>1.2对于M. adhaerens)作为光镊捕获细胞的判断依据。用户可以设置CCD相机2的阈值来自定义光镊捕获标准。
如图2a所示,一旦成功捕获细胞,RACS平台移动包含细胞的光镊到评估区域,然后根据拉曼光谱C-D指纹区域(2040–2300 cm−1)判断细胞是否含有氘标记。标记指数可以通过波长2040–2300 cm−1区域与1850–1900 cm−1区域的信号比值来计算:
选择波长1850–1900 cm−1区域作为参考是因为其对于设备材料PDMS和玻璃不敏感(而且经过前面判断已经确定包含细胞,不用再考虑空白液体的光谱)。不同物种标记的和未标记的细胞PL值如图3d所示,所有未标记的细胞PL<6.69,因此可将PL>6.69作为可靠的氘标记判断标准。
如图3b所示,经过反复测量显示细胞拉曼光谱测量时间越长,PL与PC值越稳定,PC值需要2秒时间测量足以稳定,而PL值需要5秒时间。根据这个参数,全自动化的RACS平台分选细胞的速度达到200细胞每小时(也即3.3细胞每分钟)。
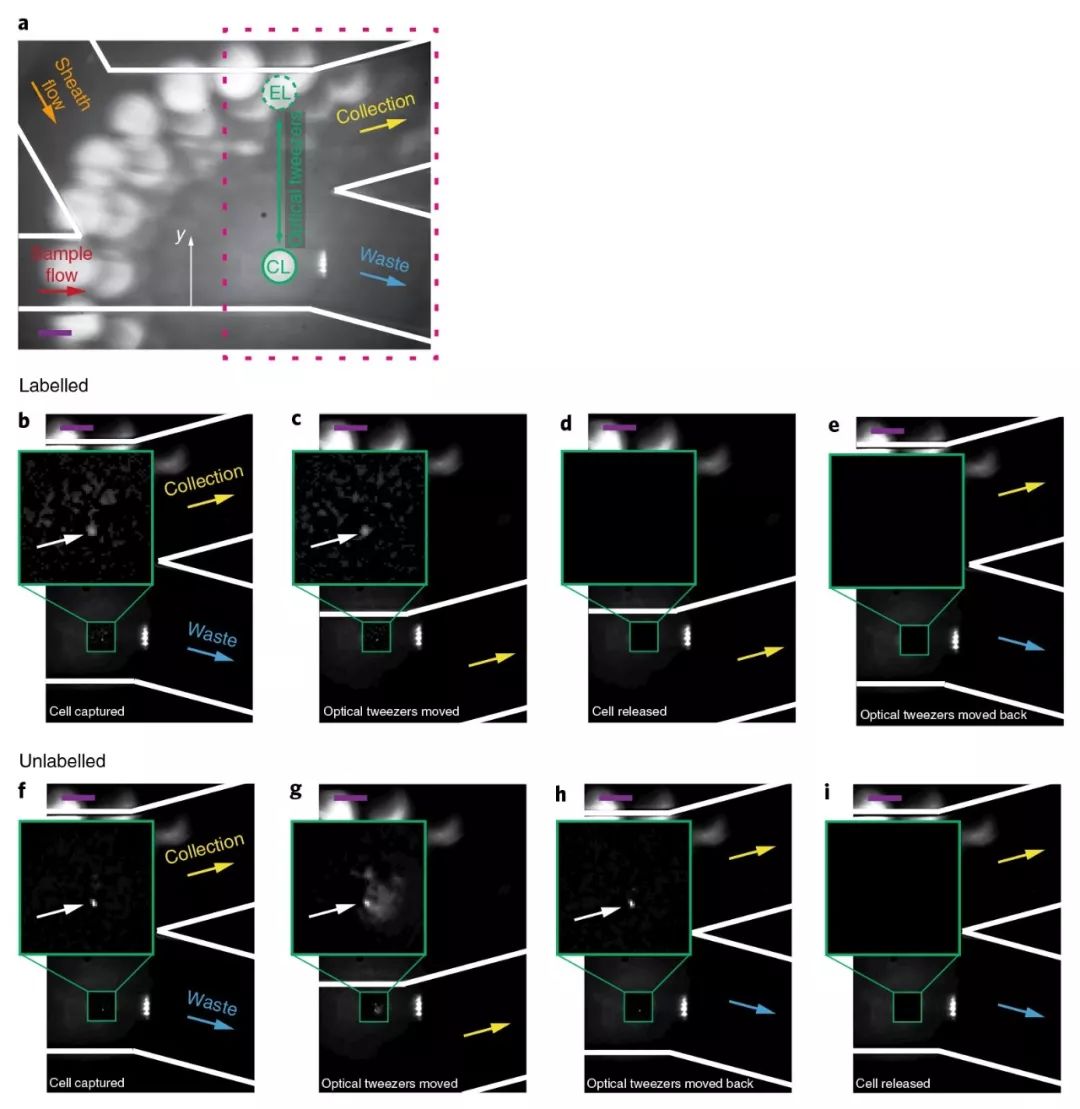
图2. 微流控装置内的细胞分选操作(a. 微流控分选的监控图,因为装置反光,光镊周围可以看到环形照明灯,CL为捕获区域,EL为评估区域,光镊在这两个区域之间往复移动 b-e. 氘标记细胞的分选过程,最终在评估区域释放被带入收集出口 f-i. 未标记细胞被带回捕获区域释放,被带入废液出口)
-
企业风采

-
招标采购
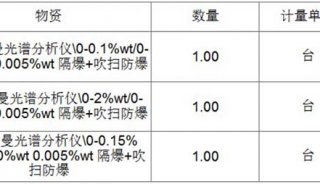
-
企业风采

-
企业风采

-
焦点事件
-
焦点事件

-
焦点事件

-
企业风采

-
企业风采

-
科技前沿

-
产品技术

-
技术原理

-
企业风采

-
标准

-
项目成果

-
科技前沿

-
焦点事件

-
焦点事件

-
企业风采

-
企业风采

-
企业风采

-
技术原理
-
产品技术

-
企业风采

-
焦点事件

-
项目成果
-
企业风采

-
精英视角

-
焦点事件

-
项目成果
-
焦点事件

-
产品技术

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
项目成果
-
科技前沿
-
焦点事件