自动化拉曼光谱仪用于活细胞功能分类(二)
3分选、回收效率和准确率
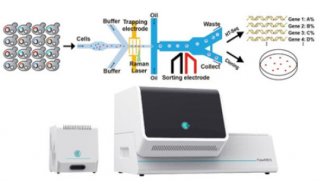
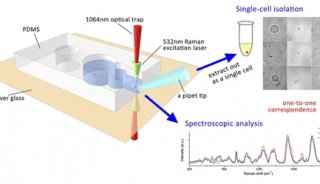
RACS平台提供一个用户友好的程序界面,用户可自定义筛选标准,操作方法如视频3所示。首先进行空白校对(calibration),然后根据用户设计的标准光镊在捕获区样品流中随机捕获细胞,根据PC判断是否成功捕获,捕获成功后移动到评估区进行拉曼光谱测量,如果满足标记细胞的标准则释放,细胞进入收集出口,否则带回捕获区的样品流中释放。
视频3. RACS平台界面及操作流程
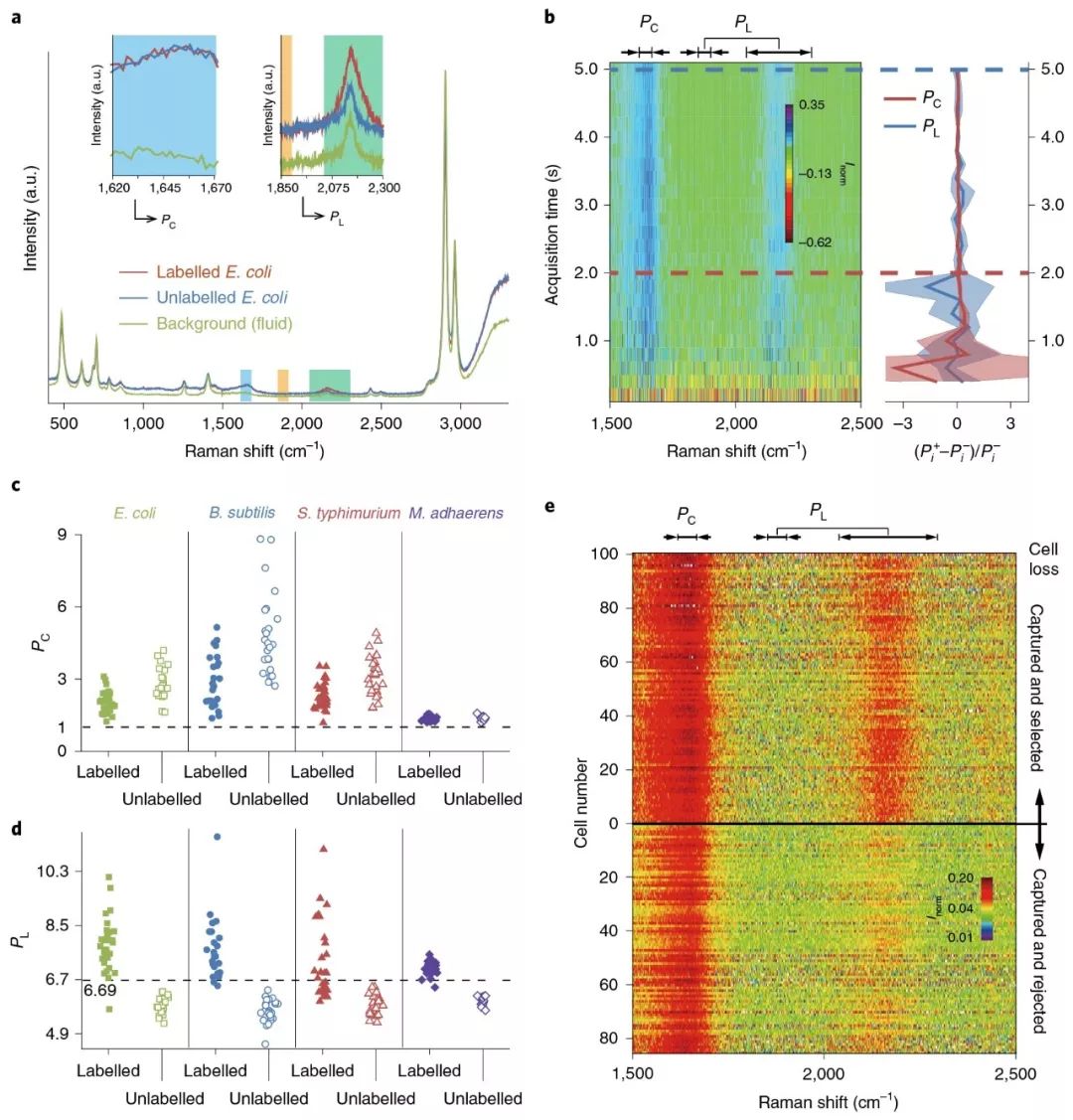
图3. RACS平台示例菌株及分选标准(a. 背景流体与标记和未标记的大肠杆菌细胞拉曼光谱比较,彩色条带分别展示了计算PC与PL所依据的波谱区域 b. 氘标记的大肠杆菌细胞PC与PL指数随测量时间的变化,热图为标准化的拉曼光谱 c. 四个测试的物种其标记与未标记细胞的PC指数对比 d. 四个测试的物种其标记与未标记细胞的PL指数对比 e. 准确率评估测试中检测的185个大肠杆菌细胞拉曼光谱对比)
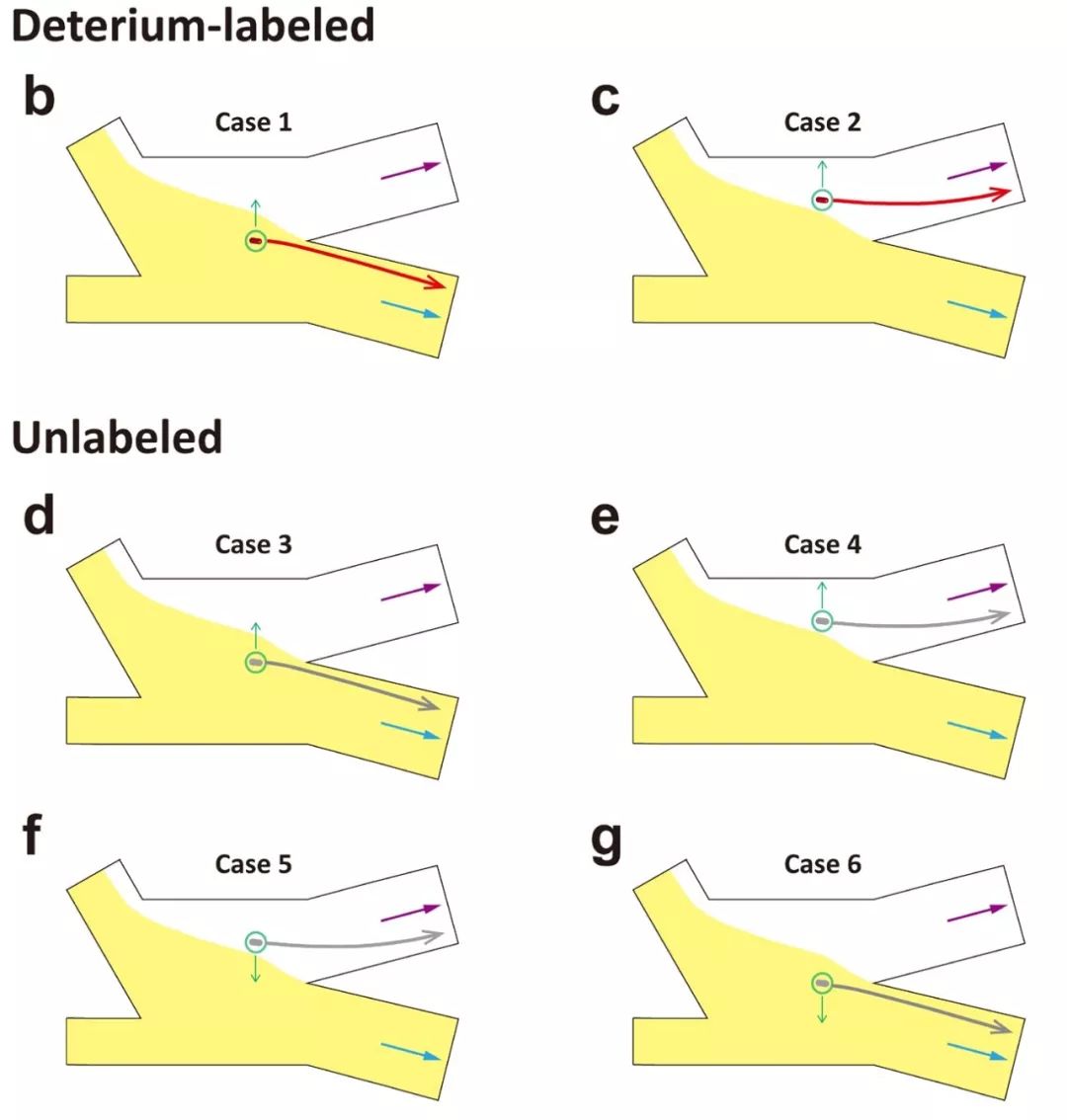
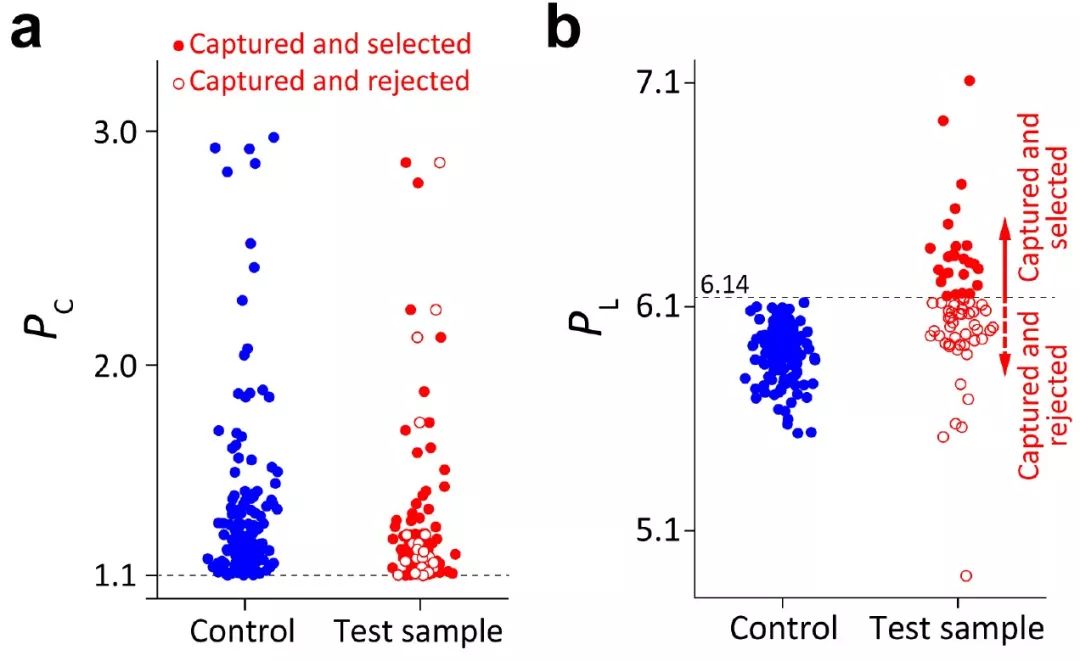
为了检测该平台分选的准确率,作者将同一物种氘标记和未标记的细胞以1:1比例混合到一起进行分选。如图3e所示,在捕获的185个大肠杆菌细胞中,100个被筛选,85个被拒绝。被筛选的大肠杆菌细胞中99.0%的细胞其拉曼光谱展示了明显的C-D峰,另外两个检测的物种分别为85.7%和96.4%。那些没有典型C-D峰但是被筛选的细胞主要是由于在光镊移动过程中细胞脱离了控制,在评估区进行测量时实际上测的是空白流体的PL值,而其值是高于6.69的。为了解决这个问题,作者总结了细胞丢失可能造成的六种情况(附件图1所示),从而预测潜在的误差(也即筛选了未标记的细胞),结果显示三个物种的误差分别为E. coli(0.3%)、B. subtilis(5.1%)和S. typhimurium(1.2%)。
附件图1. 细胞从光镊丢失的6种可能情况
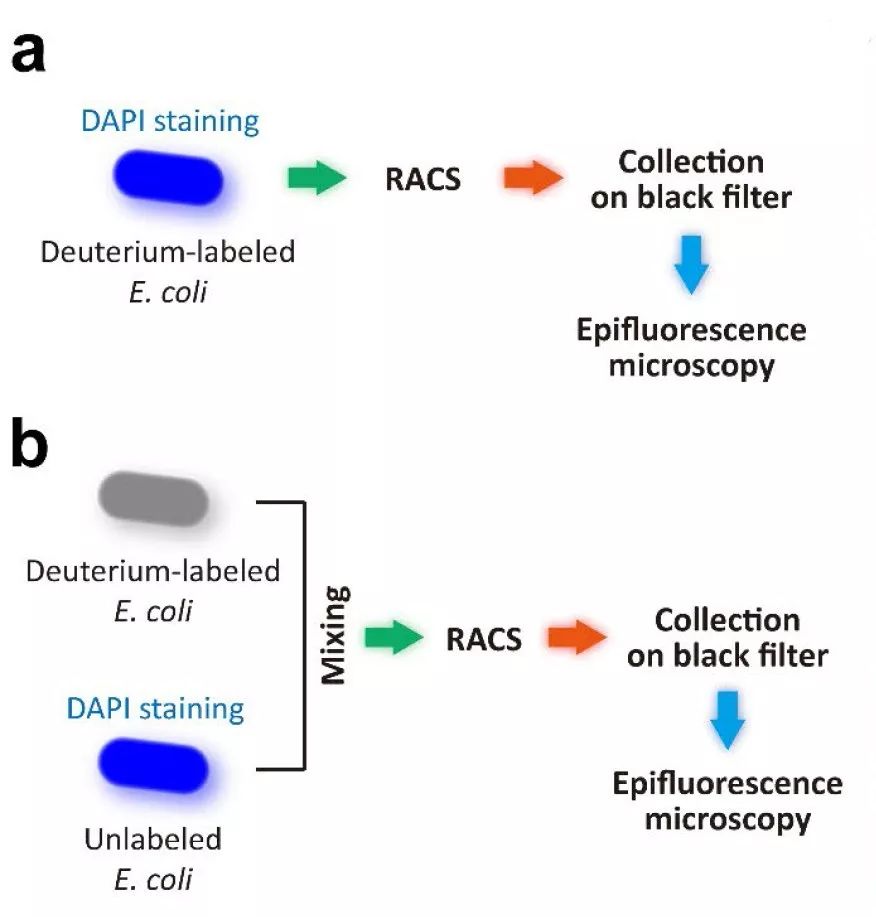
接下来作者进一步通过实验评估RACS平台。首先评估回收效率,也即实际收集出口收集到的细胞数目与平台检测出氘标记细胞信号的数目之比。作者将氘标记的大肠杆菌细胞使用DAPI染色(附件图2a所示),然后输入平台进行连续一小时的运行分选,收集到的细胞在荧光显微镜下进行计数,最终计算可得回收效率为82.1± 2.7%。接下来评估分选准确率,作者将没有氘标记的大肠杆菌细胞用DAPI染色,并与氘标记的细胞进行1比1混合(附件图2b所示),然后输入平台连续一小时的运行分选,然后检测收集的细胞中DAPI染色细胞(也即未标记细胞)的数目,最终结果为准确率98.3± 1.7%。
附件图2. RACS平台回收效率与准确率评估方案
需要注意的是,该平台不一定只分选氘标记的细胞,事实上只要找到足够的拉曼光谱特征,RACS平台可以分选任何化合物或染料标记的细胞。
4小鼠肠道微生物组中利用粘蛋白微生物的分选
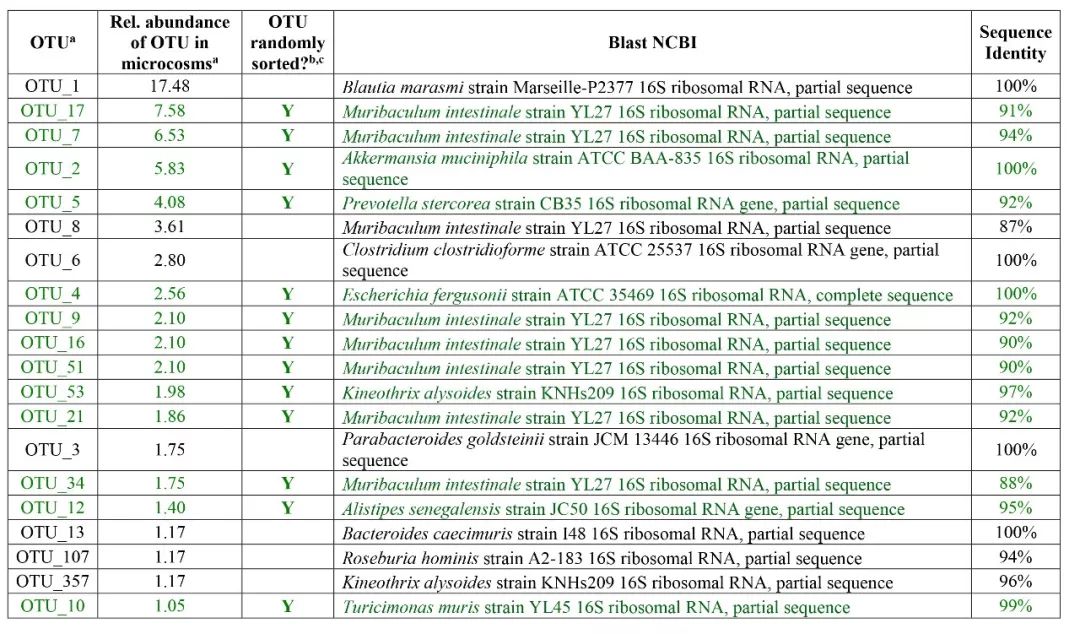
为了展示RACS平台对复杂微生物群落的应用,选择小鼠肠道样品进行测试运行。复杂微生物群落的测试对RACS平台有很大挑战,首先肠道微生物组物种多样性很高,细胞形态和大小也不尽相同。为了检测光镊是否能随机的捕获所有微生物细胞还是偏向于某种形态和大小的细胞,作者先根据PC>1.1的标准随机捕获分选细胞,然后使用16S测序分析原始微生物群落与分选后的微生物群落结构。结果显示原始样品中20个高丰度(>1%)的OTU中13个被成功捕获分选,包含了小鼠肠道微生物组的主要门类(Bacteroidetes、Firmicutes、Proteobacteria和Verrucomicrobia),证明RACS平台具有在复杂微生物群落里捕获多种细胞的能力(附件表1)。尽管如此,丰度最高的OTU并没有被成功捕获分选,然而这个偏倚可能不是RACS平台造成的,细胞裂解方法与全基因组扩增的偏倚也可能造成这种现象。
附件表1. 小鼠结肠微生物组主要OTU的捕获分选情况
将小鼠结肠微生物组的细胞使用葡萄糖在没有重水进行培养,也即所有细胞不做氘标记,输入平台发现所有细胞均有PL<6.14。然后将小鼠结肠微生物组的细胞使用葡萄糖在有重水条件下进行培养,也即所有细胞都做氘标记,根据PL>6.14作为判断标记的标准进行分选,如附件图3b所示37%捕获的细胞被成功分选,这个效率可以与人工分选媲美。
附件图3. 小鼠结肠微生物组细胞按照PC>1.1与PL>6.14标准的分选效率
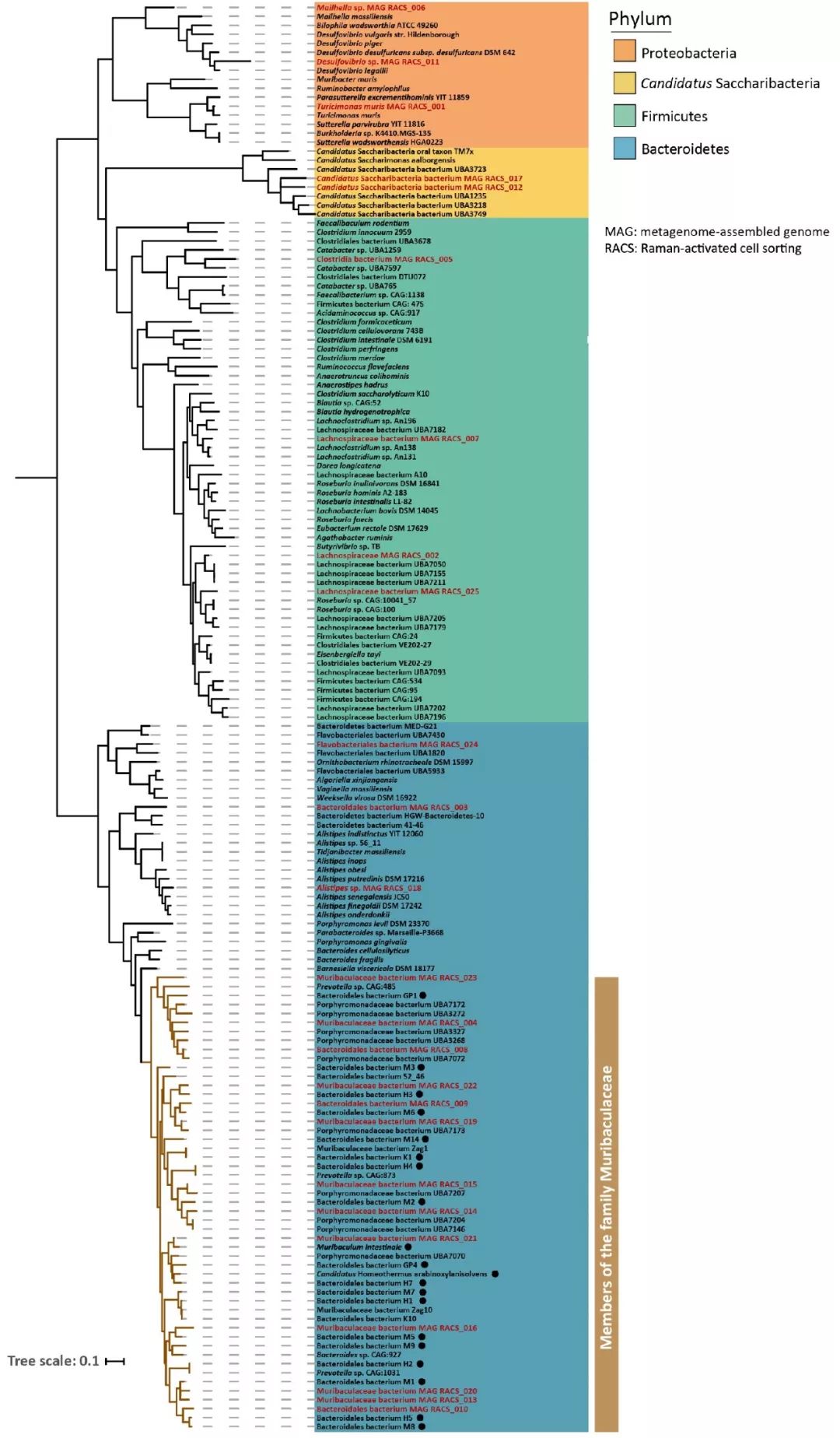
最后,将小鼠结肠微生物组的细胞使用粘蛋白在有重水条件进行培养,使得代谢粘蛋白的细胞被氘标记,使用RACS平台分选了180个细胞(如图4a所示),然后使用宏基因组学的方法进行分析。16S分析结果显示分选获得的物种在原群落中占比为27.4 ± 6.8%,而在RACS平台捕获的细胞里,最终确定为氘标记并分选的细胞占比23.7 ± 9.9%,这两个比率十分一致再次证明了RACS平台的可靠性。粘蛋白降解有关的微生物具有较高的系统发育多样性,属于4个门类Bacteroidetes、Firmicutes、Proteobacteria和CandidatusSaccharibacteria(如附件图4所示)。
附件图4. 粘蛋白降解有关物种系统发育树
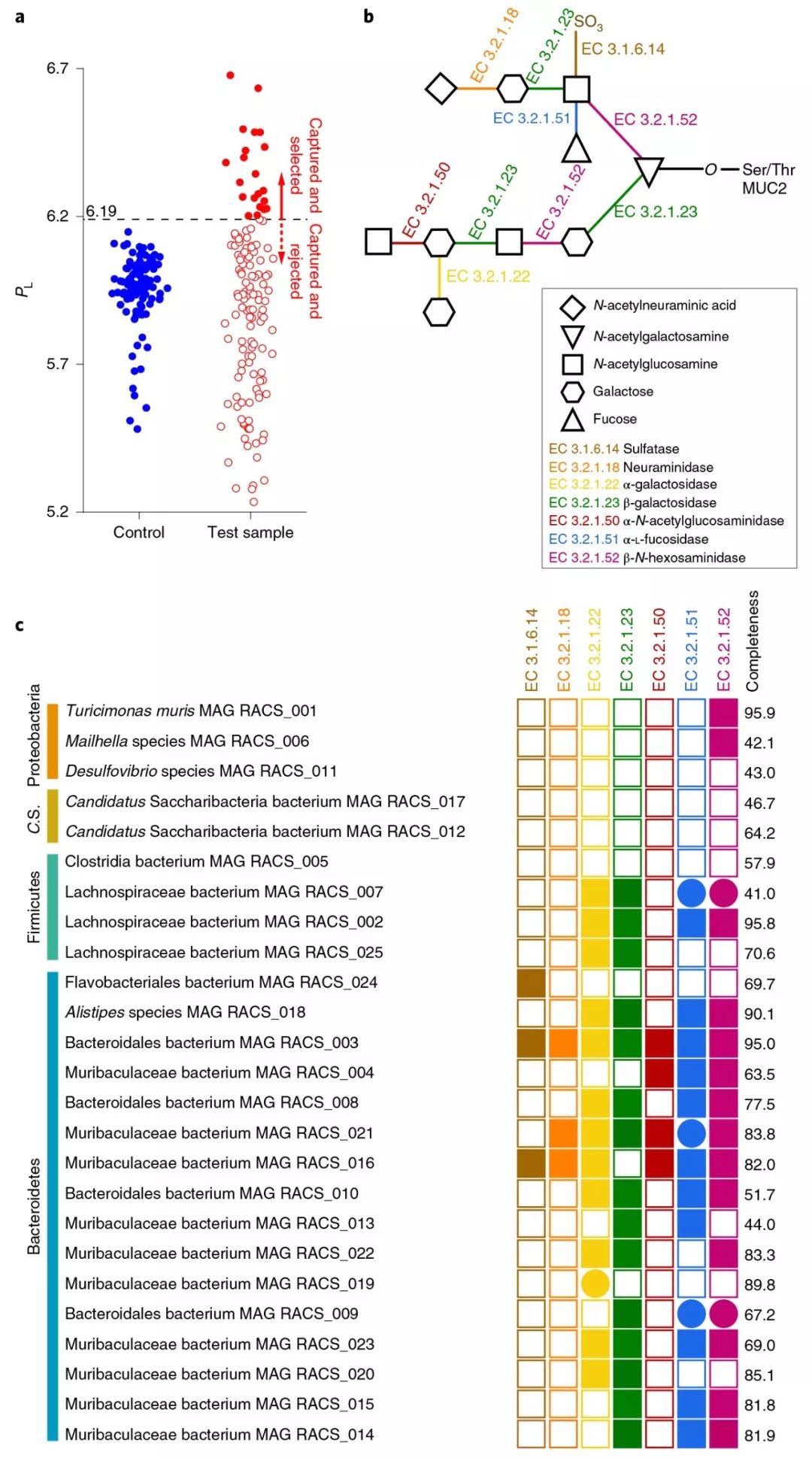
对25个宏基因组分装获得的高质量基因组进行分析,发现大部分和厚壁菌门中未培养的科Muribaculaceae是近缘的(如附件图4所示)。在这些基因组中搜寻涉及粘蛋白降解有关的酶(如图4b所示),发现84%的基因组至少能够编码一种能够打破粘蛋白聚糖的酶(如图4c所示)。
图4. 使用RACS平台分析小鼠结肠微生物组中与粘蛋白降解有关的微生物(a. 降解粘蛋白的标记细胞的判断标准及其分选结果 b. 粘蛋白降解的代谢通路及相关的酶 c. 获得的25个基因组中粘蛋白降解酶的出现情况,实心方块表示在基因组中出现,实心圆圈表示在该基因组最近缘的物种中又出现,空心方块表示不出现)
总结评论
对微生物学家来说,单细胞基因组学研究的一个最大限制就是基于功能属性将单个细胞进行分离。RACS平台的出现就是为了填补这个缺口,它适合基于代谢活性对活细胞进行分选,以方便后续的研究。RACS平台提供用户友好的界面,方便用户制定个性化分选程序,且以较高的通量进行全自动化运行(最高可达500 cells h−1)。并且经过验证,RACS平台具有很高的准确率且有处理复杂微生物群落的能力。可以期待借助此平台能更好的解决现代微生物生态中的关键问题,尤其是某些重要生物化学过程的关键参与物种。
-
企业风采

-
招标采购
-
企业风采

-
企业风采

-
焦点事件
-
焦点事件

-
焦点事件

-
企业风采

-
企业风采

-
科技前沿

-
产品技术

-
技术原理

-
企业风采

-
标准

-
项目成果

-
科技前沿

-
焦点事件

-
焦点事件

-
企业风采

-
企业风采

-
企业风采

-
技术原理
-
企业风采

-
焦点事件

-
项目成果
-
企业风采

-
精英视角

-
焦点事件

-
项目成果
-
焦点事件

-
产品技术

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
科技前沿
-
焦点事件