默沙东Recarbrio新适应症获优先审查,治疗医院细菌性肺炎

默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)已受理复方抗生素产品Recarbrio(亚胺培南/西拉司丁/relebactam)的补充新药申请(sNDA)并已授予优先审查。该sNDA寻求批准Recarbrio,用于成人患者治疗由某些敏感革兰氏阴性菌引起的医院获得性细菌性肺炎和呼吸机相关细菌性肺炎(HABP/VABP)。FDA已指定该sNDA的处方药用户收费法(PDUFA)目标日期为2020年6月4日。
默沙东研究实验室临床研究、传染病和疫苗高级副总裁Nicholas Kartsonis博士表示:“此次sNDA加强了默沙东继续致力于研究和开发潜在的抗生素治疗方案,以满足未满足的医疗需求。我们正坚定不移地致力于评估由某些革兰氏阴性病原体引起的感染的治疗方法。”
此次sNDA基于关键性III期RESTORE-IMI 2试验的结果。这是一项全球性、多中心、随机、非劣效性研究,评估了Recarbrio用于治疗HABP/VABP成人患者的疗效和安全性。去年10月,默沙东宣布该项研究达到了主要终点和次要终点:在改良的意向性治疗(MITT)群体中,早期随访显示,与哌拉西林/他唑巴坦(piperacillin/tazobactam)相比,Recarbrio在第28天全因死亡和临床应答方面具有统计学非劣效性。2组中观察到的不良事件发生率相似。该研究的全部数据将于2020年4月18日至21日在法国巴黎举行的第30届欧洲临床微生物学和传染病大会(ECCMID 2020)上公布。
在美国,Recarbrio 1.25g注射液于今年7月通过FDA的优先审查程序获得批准,用于治疗选择有限或无替代治疗选择的18岁及以上成人患者,治疗由某些易感革兰氏阴性菌引起的复杂尿路感染(cUTI,包括肾盂肾炎)和复杂性腹腔内感染(cIAI)。
Recarbrio是一款新的固定剂量组合抗菌素,通过静脉输注给药。2019年7月,Recarbrio通过美国FDA的优先审查程序获得批准,用于治疗选择有限或无替代治疗选择的18岁及以上患者,治疗由某些易感革兰氏阴性菌引起的复杂尿路感染(cUTI,包括肾盂肾炎)和复杂性腹腔内感染(cIAI)。
Recarbrio是亚胺培南-西拉司丁(imipenem-cilastatin)和relebactam的组合。亚胺培南/西拉司丁组合是一款已应用数十年的复方抗生素产品,品牌名为Primaxin/Tienam(中文商品名:泰能),该药常用于有效治疗多种细菌性感染,其中的亚胺培南是一种培南类抗菌药,西拉司丁是一种肾脏脱氢肽酶抑制剂,不具有抗菌活性,但能限制亚胺培南的肾脏代谢。
relebactam则是一种新型β-内酰胺酶抑制剂,属于二氮杂双环辛烷抑制剂,具有广谱抗β内酰胺酶活性,包括A类(超广谱β内酰胺酶和KPC)和C类(AmpC酶)。relebactam可保护亚胺培南免受某些丝氨酸β内酰胺酶的降解,针对亚胺培南耐药的革兰氏阴性菌株,联合应用relebactam时,菌株会对亚胺培南变得更加敏感。

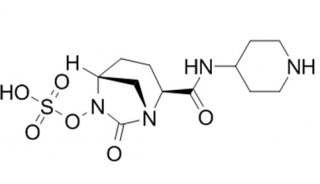
relebactam分子结构式(图片来源:medchemexpress.cn)
目前,relebactam正被评估联合imipenem-cilastatin(亚胺培南-西拉司丁)治疗某些革兰氏阴性细菌感染的治疗。此前,FDA已授予relebactam与imipenem-cilastatin组合疗法静脉注射治疗cUTI、cIAI、HABP、VABP的合格传染病产品(QIDP)和快速通道资格。
Recarbrio治疗cUTI和cIAI适应症的批准,基于关键性III期临床研究RESTORE-IMI 1的积极结果。该研究在cUTI和cIAI成人患者中开展。结果显示,用于治疗imipenem(亚胺培南)耐药感染时,在微生物改良意向治疗(mMITT)患者群体中,与Colistin(粘菌素)+亚胺培南/西拉司丁方案(COL+IMI)相比,relebactam+亚胺培南/西拉司丁方案(IMI/REL)具有良好的总缓解率和更低的肾脏毒性,具体数据为:(1)总缓解率,IMI/REL方案为71.4%,COL+IMI方案为70.0%;(2)第28天临床缓解率,IMI/REL方案为71.4%,COL+IMI方案为40.0%;(3)第28天全因死亡率,IMI/REL方案为9.5%,COL+IMI方案为30.0%;(4)药物相关不良事件发生率,IMI/REL方案为16.1%,COL+IMI方案为31.3%;(5)肾脏毒性发生率,IMI/REL方案为10%,COL+IMI方案为56%。(生物谷Bioon.com)
原文出处:FDA Accepts For Review Supplemental New Drug Application (sNDA) for RECARBRIO™ (imipenem, cilastatin, and relebactam) for the Treatment of Adults with Hospital-Acquired and Ventilator-Associated Bacterial Pneumonia (HABP/VABP)
-
焦点事件
-
并购

-
焦点事件

-
产品技术

-
焦点事件
-
项目成果
-
科技前沿
-
标准

-
焦点事件

-
项目成果
-
焦点事件
-
产品技术
-
产品技术
-
项目成果






















