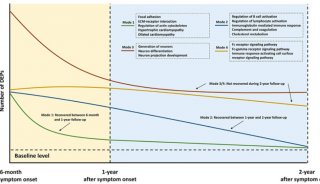
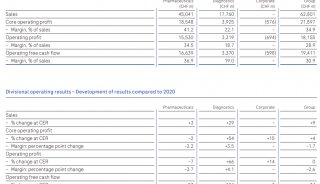
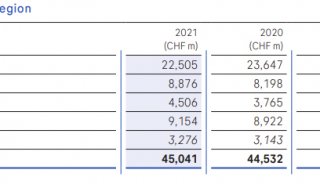
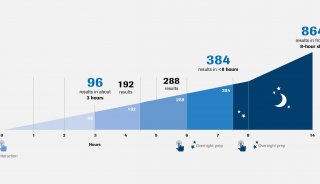
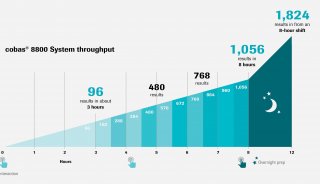
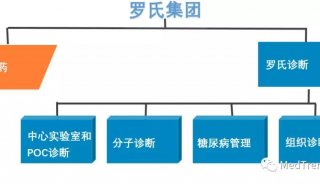
新冠疫情:2.4亿例!罗氏优先审查
目前,国外新冠肺炎疫情仍在迅速蔓延。根据百度《新型冠状病毒肺炎疫情实时大数据报告》,截止2021年10月15日02时,全球累计确诊超过2.4亿例(2.4015亿),死亡超过489万例。
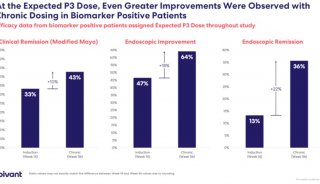
近日,再生元(Regeneron)宣布,美国食品和药物管理局(FDA)已受理COVID-19抗体鸡尾酒疗法REGEN-COV(casirivimab和imdevimab)的生物制品许可申请(BLA)并授予了优先审查:(1)用于治疗COVID-19非住院患者;(2)用于某些个体,预防COVID-19。FDA已指定目标行动日期为2022年4月13日,该机构已通知再生元,目前正计划在该日期之前召开咨询委员会会议,讨论该申请。第二份BLA预计将于今年晚些时候提交:用于治疗COVID-19住院患者。
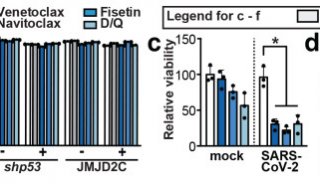
此次BLA基于涉及6000多例患者的2项阳性3期试验的数据支持。这些试验评估了REGEN-COV:(1)用于治疗已感染新型冠状病毒(SARS-CoV-2)的非住院患者;(2)用于SARS-CoV-2感染者的无症状家庭接触者(包括未感染和已感染的接触者),防止出现有症状感染。
在欧盟(EU),REGEN-COV的监管提交也在取得进展。本周早些时候,欧洲药品管理局(EMA)受理了REGEN-COV(名为Ronapreve)的营销授权申请(MAA):用于治疗已感染的非住院患者,或用于某些个体预防COVID-19。此外,再生元还计划提交一份II类变更:将REGEN-COV用于治疗COVID-19住院患者。
在美国,REGEN-COV尚未获得FDA批准,但目前已被授予紧急使用授权(EUA):在某些高危人群中用于治疗,以及暴露后预防。
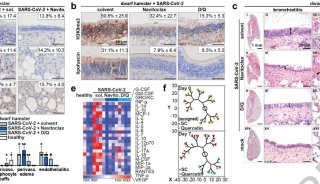
REGEN-COV是一款抗体鸡尾酒疗法,由再生元发明并与罗氏合作开发,罗氏主要负责美国以外地区的开发和供应。REGEN-COV由2种单抗(casirivimab和imdevimab)组成,这2种单抗分别针对新型冠状病毒(SARS-CoV-2)棘突蛋白(S蛋白)受体结合区域的2个独立的、不重叠的位点,具有协同作用,可降低病毒变异逃逸的风险,并保护人群免受S蛋白发生突变的病毒变体的侵害。此外,来自临床前研究的数据表明,casirivimab和imdevimab保留了针对关键的新兴变体的中和活性。
今年7月,REGEN-COV在日本获得全球首个监管批准(完全批准,商品名:Ronapreve),通过静脉输注,用于治疗轻中度COVID-19患者。此外,REGEN-COV在英国还获得了附条件批准。此外,REGEN-COV在全球40多个国家(包括美国、欧盟、印度、瑞士和加拿大)被授权用于紧急使用或临时大流行使用。(生物谷Bioon.com)
原文出处:FDA Accepts REGEN-COV® (casirivimab and imdevimab) for Priority Review for Treatment and Prophylaxis of COVID-19
-
企业风采
-
焦点事件

-
焦点事件
-
企业风采
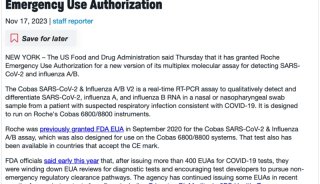
-
财报
-
焦点事件

-
焦点事件

-
财报

-
焦点事件

-
焦点事件

-
焦点事件

-
财报

-
产品技术
-
财报
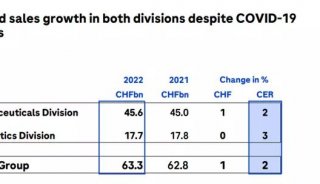
-
焦点事件

-
科技前沿

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
招标采购
-
焦点事件

-
焦点事件

-
焦点事件

-
政策法规

-
企业风采

-
焦点事件

-
科技前沿

-
焦点事件
-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
会议会展

-
焦点事件

-
科技前沿
-
焦点事件

-
财报

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
科技前沿
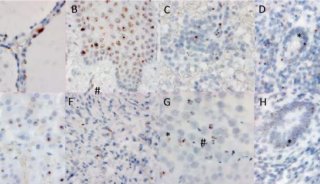
-
焦点事件

-
招标采购

-
会议会展

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
科技前沿
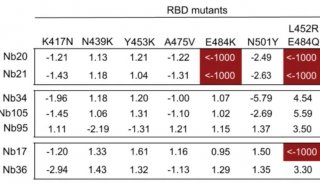
-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿
-
焦点事件

-
技术原理

-
焦点事件

-
并购

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
财报

-
焦点事件

-
焦点事件

-
焦点事件
-
财报

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
招标采购
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件
-
焦点事件

-
产品技术

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角

-
焦点事件

-
焦点事件

-
财报
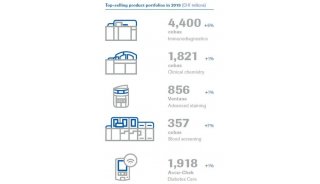
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
财报

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
招标采购
-
焦点事件

-
焦点事件
-
焦点事件
-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件
-
项目成果

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
政策法规

-
政策法规
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
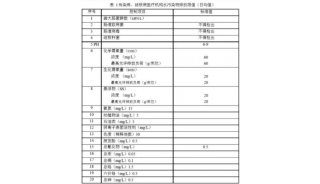
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
企业风采

-
焦点事件

-
焦点事件