植物水分胁迫轻度干旱胁迫测量新方法-OS-5P 调制叶绿...
植物水分胁迫轻度干旱胁迫测量新方法-OS-5P 调制叶绿素荧光仪
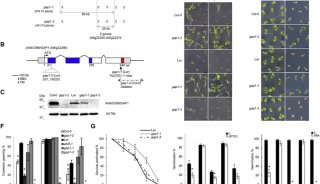
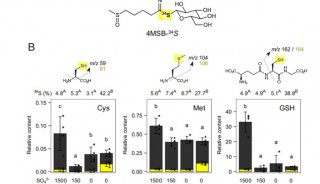
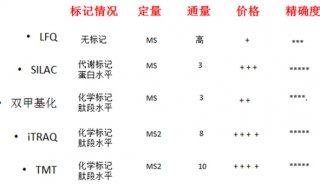
利用叶绿素荧光仪测量C3和C4植物的水分胁迫和轻度干旱胁迫一直是个难题。C4植物的水分胁迫可以通过测量光量子产量(Yield)和电子传递速率(ETR)进行判断(J Cavender-Bares & Fakhri A. Bazzaz 2004 ) (Cerovic 1996),但对于C3植物,则无法使用该方法。众多研究表明,Fs这一参数(有时候也表达为F/Fm’ 或Fms – Fs/Fms)对中度水分胁迫特别敏感(Flexas 1999 & Flexas 2000);PI参数在植物受到水分胁迫7天后,能够很好的反映状况(Thach 2007 & Zivcak M., Brestic M, Olsovska K. Slamka P. 2008);而Fv/Fm则对水分胁迫不敏感(Bukhov & Carpentier 2004)。
2007年,来自美国德克萨斯州拉伯克植物胁迫研究室的John Burke教授发表了一篇名为“棉花叶源头叶对干旱胁迫响应研究的新方法(Plant Physiology,2007,Volume143,pp108-121)”的论文,提供了一种测量植物轻度水分胁迫的新方法。
今年(2010)5月份,John Burke教授再次发表论文(Burke J., 2010)验证了上述方法并做了相应改进。Burke 指出C3和C4植物都能用这个方法测量,且可以一次性测量200~300个植物叶片样品。
该方法的理论基础主要是基于正常的叶片在夜间会将蔗糖分配到代谢库(消耗或积累同化物的器官或组织,如根、茎、果实、种子等)去,而受到干旱胁迫的叶片不会进行这一过程。
该方法从灌溉停止后一天开始,将未受到胁迫的对照植物和受干旱胁迫植物的测量结果进行对比,一直持续好几天。已有研究显示,灌溉停止后24小时之内,测量结果即能很好地反映水分胁迫状况。这一结果也得到了其它实验室(文中未列出具体名称)的验证。
测量方法步骤如下:
1、在黎明前,使用6号带有橡胶塞的打孔器从植株的叶源头叶(不同植物位置可能不同)上进行钻孔采样,将采集的所有叶片迅速置于一个每个格子都注了水的24格样品盘上,迅速盖上样品盒的盖子。这个操作过程中的关键点是要让叶片一直保持湿润。
2、回到实验室后,将植物叶片样品转移到耐热玻璃盘内的湿润凝胶干燥滤纸上,上面盖上可以透过CO2的保鲜膜,并用滚筒轻轻滚动以除去气泡并确保叶片和滤纸之间接触紧密。
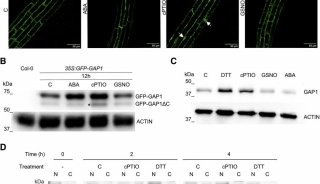
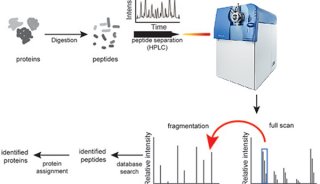
3、将样品放在荧光灯下进行诱导(这和真正的暗适应还是有区别的),然后使用美国OPTIC公司的OS-1FL调制式叶绿素荧光仪(现在被新型号OS-1P取代)测量初始的暗适应参数Fv/Fm’ (△F/Fm’)或光适应参数Yield,测量时将荧光探头垂直于植物叶片上方,并将探头紧贴保鲜膜,使叶片样品有短暂的几秒钟暗适应,然后按下测量激发按钮进行光量子产量测量,所有的样品叶片和对照叶片都用此步骤测量。
4、测量完成后,将样品放入已经预热了的低温干燥箱中,在40℃在条件下烘30分钟,按照上述步骤再次测量暗适应参数Fv/Fm’ (△F/Fm’)或光适应参数Yield,对比前后测量结果值,从而判断植物受到的胁迫程度。
5、加热之后叶片的荧光测量结果如果显著降低,则表明叶片未受到水分胁迫;如果加热之后叶片的荧光测量变化较小,则表明该叶片受到了水分胁迫。”
注:美国OPTIC公司的OS5P调制试荧光仪也可以完成这个测量。
附录:实验中使用的器具和仪器图片



参考文献:
References:
New Paper
Burke J., Franks C.D. Burow G., Xin Z. (2010) Selection system for the Stay-Green Drought Tolerance Trait in Sorghum Germplasm, Agronomy Journal 102:1118-1122 May 2010
Bukhov & Carpentier. 2004. Effects of Water Stress on the Photosynthetic Efficiency of Plants, Bukhov NG., & Robert Carpentier, From Chapter 24, “Chlorophyll a Fluorescence a Signature of Photosynthesis”, edited by George Papaqeorgiou and Govindjee, published by Springer 2004, PO Box 17, 3300 AA Dordrecht, The Netherlands, page 627-628
Burke J. (2007) Evaluation of Source Leaf Responses to Water-Deficit Stresses in Cotton Using a Novel Stress Bioassay, Plant Physiology, Jan. 2007, Vol 143, pp108-121
Cavender-Bares J. & Fakhri A. Bazzaz 2004 – “From Leaves to Ecosystem: Using Chlorophyll Fluorescence to Assess Photosynthesis and Plant Function in Ecological Studies”. Jeannine Cavender Bares, Fakhri A. Bazzaz, From Chapter 29, “Chlorophyll a Fluorescence a Signature of Photosynthesis”, edited by George Papaqeorgiou and Govindjee, published by Springer 2004, PO Box 17, 3300 AA Dordrecht, The Netherlands, page 746-747
Cerovic Z, Goulas Y. Gorbunov M, Britantais J-M, Camenen L, & Moya I., (1996) Fluoresensing of water stress in plants. Diurinal changes of mean lifetime and yield of chlorophyll fluorescence, measured simultaneous at distance with a Lidar and modified PAM-fluorometer, in maize, sugar beet and Kalanchoe. Remote Sens Environment 58:311-321
Flexas 1999 – “Water stress induces different levels of photosynthesis and electron transport rate regulation in grapevines” J. FLEXAS, J. M. ESCALONA & H. MEDRANO Plant, Cell & Environment Volume 22 Issue 1 Page 39-48, January 1999
Flexas 2000 – “Steady-State and Maximum Chlorophyll Fluorescence Responses to Water Stress In Grape Vine Leaves: A New Remote Sensing System”, J. Flexas, MJ Briantais, Z Cerovic, H Medrano, I Moya, Remote Sensing Environment 73:283-270
Thach L. B., Shapcott A., Schmidt S. Critchley C. “The OJIP fast fluorescence rise characterizes Graptophyllum species and their stress responses”, Photosynth Res (2007) 94:423–436
Živčák M., Brestič M., Olšovská K., Slamka P.(2008) Performance index as a sensitive indicator of water stress in Triticum aestivum PLANT SOIL ENVIRON., 54, 2008 (4): 133–1
-
焦点事件
-
项目成果
-
科技前沿

-
科技前沿
-
焦点事件

-
精英视角

-
科技前沿
-
科技前沿

-
科技前沿
-
项目成果
-
项目成果

-
焦点事件

-
项目成果

-
项目成果
-
项目成果

-
焦点事件

-
科技前沿
-
科技前沿
-
项目成果
-
项目成果
-
焦点事件

-
项目成果

-
项目成果

-
政策法规

-
项目成果
-
科技前沿
-
科技前沿

-
项目成果

-
焦点事件