高效液相色谱仪串联质谱仪检测醋酸甲地孕酮和醋酸甲...
一、范围
本标准规定了测定动物食品中醋酸甲地孕酮和醋酸甲羟孕酮残留量的方法及测定高效液相色谱仪串联质谱仪的方法。本标准适用于肌肉、脂肪、肝、肾、乳中醋酸甲羟孕酮和醋酸甲羟孕酮残留量的测定。
二、规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,只有注日期的版本适用于本文件。对于未注明日期的参考文件新版本(包括所有修订)均适用于本文件。GB/T 6682分析实验室用水规范和试验方法。
三、原理
将醋酸甲羟孕酮和醋酸甲羟孕酮分别用乙腈、正己烷脂质体、混合阳离子柱纯化,用甲醇洗脱,用高效液相色谱法(HPLC)串联质谱法测定,用内标法定量测定。
四、试剂与材料
除另有规定外,所有试剂均为分析纯,水为GB/T 6682规定的一级水。
4.1 试剂
4.1.1乙腈(CH3CN):色谱纯。
4.1.2甲醇(CH3OH)。
4.1.3甲酸(HCOOH):色谱纯度。
4.1.4 乙酸(CH 3 COOH)。
4.1.5正己烷(C6H14)。
4.1.6乙酸乙酯(CH3COOC2H5)
4.1.7乙酸铵(CH 3 COONH 4)。
4.2 溶液配制
4.2.1mol/L醋酸铵缓冲液:醋酸铵15.4g,加入水900 ml溶解,用醋酸调节pH值至5.2,用水稀释至1000 mL。
4.2.2 2%甲酸水溶液:取甲酸2ml,加水溶解,稀释至100ml。
4.2.30.1%甲酸水溶液:取1ml甲酸溶于水,稀释至1000 mL。
4.2.4 50%甲醇水溶液:取甲醇50ml,加水溶解,稀释至100ml。
4.2.530%甲醇溶液:30mL甲醇,溶于水,稀释至100mL。
4.2.6 0.1%甲酸乙腈水溶液:取0.1%甲酸水溶液20ml,加乙腈溶解,稀释至100ml,混匀。
4.3 标准品
醋酸甲地孕酮和醋酸甲地孕酮的含量为98.0%。
4.3.2内标:醋酸甲羟孕酮,含量≥98.0%。
4.4 标准溶液制备
4.4.1标准液:获得约10 mg醋酸甲羟孕酮和10 mg醋酸甲羟孕酮。在100 ml棕色瓶中,用乙腈溶解稀释,制得浓度为0.1mg/mL的醋酸甲羟孕酮和醋酸甲羟孕酮标准溶液。-保质期为6个月。
4.4.2内标储存液:取醋酸甲羟孕酮标准品10mg左右,精密称定,用100mL棕色量瓶溶解,用乙腈稀释至刻度,制备0.1mg/mL甲羟孕酮储备液。-20℃保存6个月。
4.4.3混合标准溶液:精密测量醋酸甲地孕酮和醋酸甲羟孕酮标准品贮备液0.5mL,用50mL棕色溶液中乙腈稀释至刻度,配制浓度为1µg/mL的混合标准溶液。储存在4℃以下,为期1个月。
4.4.4内标工作液:准确测量0.5mL内标原液,用乙腈稀释内标原液,制备浓度为1g/mL的内标工作液。储存在4℃以下,为期1个月。
4.4.5 标准曲线的制备
通过使用适当量的标准工作液和内标工作溶液,制备浓度为2,5,25,50和100ng/ml的一系列标准溶液(内标20ng/ml)。以特征离子色谱峰面积比为纵坐标,以标准溶液浓度为横坐标绘制标准曲线。
4.5 材料
4.5.1混合阳离子固相萃取柱:60mg/3mL,或等效物。
4.5.2β-葡萄糖苷酶/芳基硫酸酶。
4.5.3微孔膜:0.22μm。
五、仪器和设备
5.1高效液相色谱串联质谱仪:分布喷雾离子源。
5.2分析平衡:意义0.00001g和0.01g。
5.3 氮吹仪。
5.4涡流混合器:3000r/min。
5.5 超声波萃取仪。
5.6液体转移枪:200、L、1mL、5mL。
5.7离心机:10000 r/min。
5.8.梨瓶:100 mL。
5.9 旋转蒸发器。
5.10固相萃取装置。
六、试料的制备与保存
6.1 试料的制备
取适当量的新鲜或未冷冻的空白或试验组织,绞碎,混匀。脂肪组织在60℃的水浴中融化。
以均质试验样品为试验材料。
以均质化空白样品为空白样品。
_在均质化后取出空白样品,加入适当浓度的标准工作液,并将样品添加为空白。
6.2供试品的贮存温度:18℃以下,3个月内分析测试。
七、测定步骤
7.1 酶解
取样品2g(准确至20 mg),在50 mL离心管中加入40 L内标工作液,加入0.2 mol/L乙醇酸乙酯缓冲液4mL,加入葡萄糖醛缩酶/芳基硫酸盐酶稀释液40&mU;L,37°;C,37°,12h。
7.2 提取
7.2.1 肌肉、肝脏、肾脏组织
酶解后,加入10ml乙酸乙酯,在涡流振荡器上剧烈振荡10min,以4000r/min离心5min,取上清液于梨形瓶中。再次用乙酸乙酯10ml再次提取残余物,合并培养基并在50℃下蒸发至干燥。加入10ml乙腈和5ml正己烷溶解,移入50ml离心管中,低速涡流10s,3000r/min离心2min,丢弃正己烷层,旋转下层溶液,50℃蒸干,加入3ml 30%甲醇水溶液,溶解备用。
7.2.2 脂肪组织
酶水解后,将样品加入10ml乙腈并在涡旋振荡器上剧烈振荡0.5分钟,在50°C下超声提取10分钟,在4000r/min离心5分钟,将上清液转移到另一个50ml离心管中。在残渣中加入10毫升乙腈,再次提取。将上清液加入正己烷4ml,低速涡旋10s,用3r/min离心弃去正己烷层2min。加入4毫升正己烷并再次脱脂。下层旋转,在50℃下蒸发至干燥。加入30%甲醇水溶液溶解3ml。
7.3 净化
混合阳离子固相萃取柱分别用3ml甲醇和3ml水活化。取备用液通过塔,分别用水和3ml 50%甲醇溶液冲洗,排干。洗脱液用5mL甲醇洗脱,洗脱液经50℃干燥。C.氮下。用0.2ml乙腈(80%)-0.1%甲酸溶液溶解残渣,旋涡混合,过0.22μm滤膜或15000转/分高速离心10分钟,取上清液,送高效液相色谱-串联质谱仪测定。
7.4 测定
7.4.1 高效液相色谱仪参考条件
(A)柱:C18柱(50毫米、2.1毫米、1.7米)或同等;
b)流动相:A:0.1%甲酸乙腈,B:0.1%甲酸溶液,梯度洗脱,见表1;
(C)流速:0.2mL/min;
d)柱温:30 ℃;
e)进样量:10μl。
7.4.2 质谱参考条件
a)离子源:电喷雾(ESI)离子源;
b)扫描方式:正离子扫描;
c)检测方式:多反应监测;
d)电离电压:3000 V;
e)源温:100 ℃;
f)雾化温度:350℃;
g)锥孔气流速:25 L/h;
h)雾化气流速:450 L/h;
i)定性离子对、定量离子对和碰撞能量示于表2中。
7.4.3 测定法
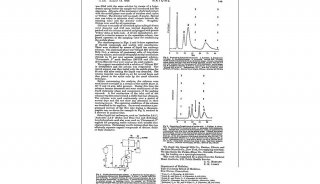
取样品溶液和标准溶液进行单点或多点校准,按内标法峰面积比计算。样品溶液和标准溶液中醋酸甲羟孕酮与氘代甲孕酮的峰面积比值应在仪器检测的线性范围内。与标准溶液相比,样品溶液的离子相对丰度满足表3的要求。附录A显示了醋酸甲羟孕酮、醋酸甲羟孕酮和氘化甲孕酮的特征离子质量色谱图谱。
7.5 空白试验
除不加试料外,均按上述测定步骤进行。
八、结果计算和表述
试样中待测药物的残留量按式(1)计算:
式中:
x-待测试物质的残留量,以每公斤微克计(微克/千克);
Cs——标准工作溶液中受试物的浓度,单位为纳克每毫升(ng/ml);
C样品溶液中内标物浓度为每毫升(ng/ml);
cis——标准工作溶液中内标物的浓度,单位为ng/ml;
A—试样溶液中被测物质的峰面积;
A为标准工作液内标的峰值面积;
A为样品溶液中内标物的峰面积;
被测物质在AS标准工作液中的峰面积;
V——试样溶液定容,单位为毫升(ml);
m —试料质量,单位为克(g)。
计算结果需从空白值扣除。测量结果用两次平行测定的算术平均值表示,并保留三位有效数字。
-
招标采购

-
市场商机

-
市场商机

-
招标采购

-
企业风采

-
市场商机

-
市场商机

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件