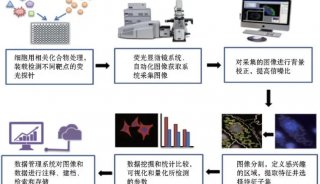
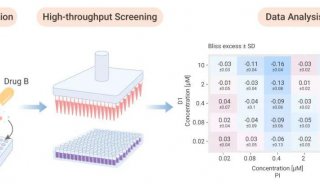
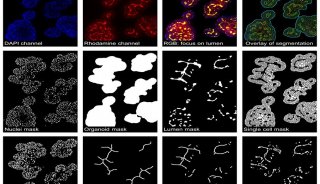
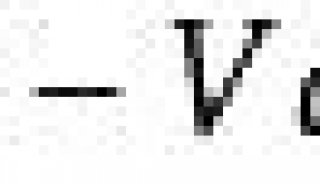昆虫细胞--高MOI杆病毒感染
高MOI( Multiplicity Of Infection,等于用于感染的病毒数目与细胞数目的比值)感染是生产蛋白的最好方法。这有两个原因。一是不用考虑DIP(Defective Interfering Particles,即只包装入部分基因组的病毒颗粒)的形成,因为关心的是细胞或者培养液中的蛋白;二是高MOI感染是最便于控制、重复性好的方法,以达到高的蛋白表达水平。
低MOI感染也可用于生产蛋白,但是难以控制,难以达到最高的表达量。然而病毒需要量少的确是该法的一个优点,对于大规模的生产这个优点极为有利,只要它们可以可靠的复制,这因不同的重组病毒而异。
一般说来,用高MOI感染的方法就是将培养液中所有的细胞同时感染,每个细胞至少感染一个病毒颗粒。这个过程的几率可以用Poisson分布来分析,简而言之,如果你想同时把所有的细胞都感染,MOI值应该接近3。由于一旦加入病毒细胞就不再生长,因此你可以精确的控制感染时细胞的密度,这个密度大约应该大约是平台期最大密度的一半。随着细胞株的不同,大约在1.5~2.5×106细胞/ml之间。
重要的是培养液的量要满足细胞生长的需要,否则将没有足够的营养使细胞生产病毒或者蛋白。另一方面,病毒也不可以太多,以免在细胞增殖到合适密度并用掉所有营养资源之前就被杀死。用高MOI感染的方法,这些条件比较容易优化,只需准备密度变化在1~3×106细胞/ml之间的一系列细胞培养物,以固定的细胞:病毒比例去感染细胞,筛选蛋白产量最高时的那个密度即可。
采用这个方法需要你使用足够量的病毒使细胞生长立即停止。病毒量可以通过进行一个小量实验来确定,先使细胞达到上面确定的最优密度,然后变化病毒的量确定感染率。高MOI感染的最大的缺点是需要准备大量的高滴度病毒,这个缺点在大量生产时尤为突出。例如,如果你的病毒不能形成高滴度的溶液,只能达到3×107pfu/ml左右,你需要加相当于细胞培养物20%体积的病毒。如果细胞的密度为2.5×106,体积为8升,那么为了得到密度为2×106细胞/ml的被感染细胞,需要加入2升病毒!你的细胞必须能够生长到较高的密度--2×106细胞/ml,并且保持对数期良好状态,你必须加入相当于终体积20%的培养液以达到最终体积,这是实验能够顺利进行下去的极限。
然而,如果你可以得到高滴度的病毒以满足感染的需要,这种方法的产量、可重复性非常高。因此,我建议在表达一个新的蛋白时,开始最好先试用这种方法。并且用这种方法得到的蛋白的产量可作为衡量其它方法(低MOI感染)产量的标准。尤其是当你的培养物体积小时(小于500ml),这是最好的方法。
步骤
将你的细胞以2~8×105细胞/ml的密度分装到摇瓶或者搅拌器中,达到摇瓶体积的20~40%,记得留出一些空间以待于将来加病毒。当培养物的体积小于500ml时,我更喜欢用摇瓶。在27±2℃培养,转速为100~130rpm。
第0天
培养细胞至密度达到大约1.5~2.5×106细胞/ml,即最大密度的一半。这可能需要多于1天的时间,与接种密度有关。
加入足够的病毒,以使所有的细胞被同时感染,但是避免加入的病毒体积多于终体积20%,最好不要多于10%。加入的量取决于病毒的滴度。
如果细胞的密度为2×106细胞/ml,病毒的滴度为5×107pfu/ml,要达到MOI值为3,需要加入12%体积的病毒。
将摇瓶放回27℃摇床,培养24小时。
感染后第1天
计数细胞,估计细胞大小。如果是在高MOI下感染,那么所有的细胞都已经被感染。它们与第0天比将不会在数目上增长,并且在细胞形态上显著膨胀。此时很容易看到细胞表面变得粗糙,这是病毒正在出芽的结果。
如果发现细胞数目有所增多,可能是由于对病毒滴度的估计偏高,使得细胞没有全部被病毒感染。这种现象在MOI值大于3时很少出现,因为一般的杆病毒噬菌斑实验结果通常是低估病毒的滴度。如果细胞数目的增长没有超过25%,可能只会影响最佳收获时间。平均每个细胞生产的蛋白量也会稍低。
感染后第2天
再次计数细胞,估计细胞大小。此时与第1天比细胞数目无论如何都不应该再增长。如果增长了,你的感染可能分布不均匀,很可能是病毒滴度低造成的。
此时细胞应该大大膨胀,细胞核占据了细胞的大部分空间。
此时可能是细胞或者培养液的时间了,这因不同的蛋白而异。大多数蛋白的产量在感染后48~72小时之间不会再有增长。不过这需要实验来确定。
感染后第3天
再次计数细胞,估计细胞大小。此时所有的细胞应该已经被彻底感染,细胞膨胀并且生长停止,否则就说明没有足够的病毒使细胞在达到平台期之前停止增长。收获培养物,离心分离细胞,将培养液避光保存于4℃,或者冻存于-70℃。
通常最好将细胞沉淀冻存。我喜欢的方法是将细胞重悬于小量(比如1/4体积)的PBS或者TBS(含有浓度为通常5倍的蛋白酶抑制剂)中,充分重悬后直接用微量移液器加入充满液氮的干净Dewar瓶中。滴下的重悬物遇到液氮迅速冻结形成小球,这些小球可以被分装到50ml圆锥管中,冻存于Revco冰箱中。当需要从细胞中纯化蛋白时,只需将这些小球逐个加入到3~5倍体积室温下不断搅拌的裂解缓冲液中,它们将很快融化,使缓冲液降至接近0℃。这些小球还可以用镊子方便的转移到eppendorf管中作小量实验。
-
焦点事件

-
招标采购

-
招标采购

-
市场商机

-
精英视角

-
会议会展

-
企业风采

-
焦点事件

-
企业风采

-
企业风采

-
焦点事件

-
招标采购

-
招标采购

-
企业风采

-
企业风采

-
焦点事件

-
技术原理

-
财报

-
科技前沿
-
企业风采

-
科技前沿

-
科技前沿
-
焦点事件
-
技术原理
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
项目成果
-
焦点事件

-
项目成果
-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
技术原理