在GAMP5环境下的小型实验室设备的风险分析(三)
适用于软件类别 3 的天平的基础风险模板
所选的分析矩阵:
W = 出现故障的概率:
频率,可能出现多少次故障,相对于总量。
W | 百分比估计 | 点 |
不可能 | 低于 1 % | 1 |
中等 | 至 50 % | 2 |
高 | 高于 50 % | 3 |
A = 对产品质量或病人/运输者的影响
A | 点 |
几乎没有影响 | 1 |
中等严重故障 | 2 |
极其严重故障 | 3 |
E = 发现概率,受影响:
• 控制的数量(在生产期间,交付时,检查,...)
• 控制的花费
E | 百分比估计 | 点 |
高 | 高于 50 % | 1 |
中等 | 至 50 % | 2 |
不可能 | 低于 1 % | 3 |
RPZ = 风险优先数(分析)
根据公式计算风险优先数 (RPZ):
风险优先数 (RPZ) = (W) x (A) x (E) |
计算后,各个风险优先数的范围是:
1 ≤ RPZ ≤ 27。
风险优先数可以作为结果输入到 GMP 临界栏中。无论如何应该作记号,是否涉及到 GMP 临界风险(自 RPZ ≥3 起有效)。哪些风险优先数作为“临界”、“可接受”或“非临界”归类将取决于风险优先数值范围的所选等级。因此,用户必须在了解对病人安全的影响后,才能定义作为“临界”、“可接受”或“非临界”归类的风险优先数范围。
归类为临界的风险优先数,必须定义并转化补救措施。
这些措施可能是被占用的、能控制风险的测试和流程。也包括组织措施,如规定、培训等或系统更改。目标一直在于控制风险。在通过措施后将再次分析风险,以便显示现在可控制的风险。
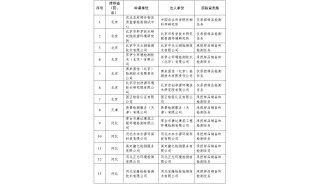
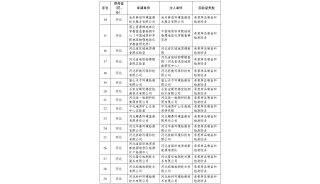
摘录源自一个天平的风险分析模板:
编号 | 功能/对象 | 潜在故障 | 分析 | GMP 临界 | 措施/注解 | 分析 | GMP 临界 | ||
W | A | E | W | A | E | ||||
15 | 计算机确认 | 没有或错误确定,是否需要计算机确认 |
H
L | 确定是否需要计算机确认 | |||||
故障查询 | H | ||||||||
虽然需要,但未执行计算机确认 | |||||||||
故障结果 | L | ||||||||
不符合 GMP 的作业 | |||||||||
编号 | 功能/对象 | 潜在故障 | 分析 | GMP 临界 | 措施/注解 | 分析 | GMP 临界 | ||
W | A | E | W | A | E | ||||
16 | 访问权限 | 未授权的用户不能使用分配的功能 |
H
L
| 确定标准软件的访问权限,可能使用这些功能 | |||||
故障查询 | H | ||||||||
不能确定访问权限 | |||||||||
故障结果 | L | ||||||||
不合理的数据交流 |
插图 7:摘录源自天平风险分析技术文档(Sartorius AG – 创建人:Steinbeis Transferzentrum 药品– 医疗卫生器材 - 化妆品)
在这篇文章中将详细涉及到风险技术文档。这与
GAMP 5 中所强调的基于风险的使用相吻合。当然,制造商将提供所有必需的标准技术文档(制造商证书和产品证书、技术规格/数据页、运输者手册
(SOP) 和 DKD/USP 测量日志)。每位有资格的制造商都能提供该服务,并附加提供使用寿命相关服务(校准、保养)。
在范例分析 1 中:
插图 8:基于风险使用适合的 GMP 计算机支持的系统(源自 GAMP 5 操作手册 (ISPE))
此处无需任何计算机确认,因为涉及到“独立”设备。不能进行数据迁移。
充分贯彻 IQ 和 OQ,通过风险分析加以支持。应该存在设计说明书,随后将创建需求规格说明。显示如何转化来自设计说明书的要求。
在范例分析 2 中:
参见插图 8。
作为范例分析 1 的扩展将检查数据接口,以确保数据迁移。这可以通过抽样调查实现最佳的、有案可循的确保。
未进行源代码检测。
如在范例分析 1 中充分贯彻 IQ 和 OQ,通过风险分析加以支持,同样在范例分析 1 中应该存在设计说明书和需求规格说明。
4. 最后的备注:
供货商的 QM 系统在小型设备中同样十分重要,例如天平。通过准备好的供货商审计和供货商技术文档应用可以在前期阶段就明显减少花费。此外,制造商必须注意并占用“质量源于设计”附加物,因为一般而言,质量的“进入测试”要承担风险。
作为小型制造设备和实验室设备的天平,与其他系统和设备相比较,归类并不复杂。 可以根据 GAMP 5 的建议(基于各自的风险考虑!)、一直以 GAMP 5 所允许的 ' 花费少' 模式进行花费确认。此外支持由制造商(作为专家)提供的风险模板和技术文档,时间和花费减少。
技术文件:
良好的自动生产实践经验,版本 5 (GAMP5),ISPE 2008。
欧洲联盟委员会,企业和工业:关于生产人类和兽医药品的良好实践经验的欧盟指引,部分 1 – 对医药产品的基本要求,附录 15“资格和确认”,2001 年 7 月。
欧洲联盟委员会,企业和工业:关于生产人类和兽医药品的良好实践经验的欧盟指引,部分 1 – 对医药产品的基本要求,附录 20“质量风险管理”,2008 年 3 月。
ICH Q 8,药物开发:2008 年 11 月。
ICH Q 9,质量风险管理:2005 年 11 月。
ICH Q 10,药品质量体系:2008 年 6 月。
撰稿人:
Ingrid Müller 博士教授 (HS Albstadt-Sigmaringen,制药工业技术大学课程)
Elke Weber 工学硕士 (HS Albstadt-Sigmaringen,制药工业技术大学课程)
Hartmut Meier 工学硕士 (IHM Hartmut Meier 工程局,Engen)
Klaus Thornagel 工学硕士 (Director ISPE D.A.CH)
Ingolf Popel 市场/销售/服务副总裁(赛多利斯科学仪器(北京)有限公司)
-
焦点事件
-
政策法规
-
标准

-
焦点事件

-
焦点事件

-
招标采购

-
焦点事件

-
焦点事件

-
招标采购

-
产品技术

-
企业风采

-
会议会展

-
产品技术

-
会议会展

-
精英视角

-
焦点事件

-
焦点事件

-
焦点事件