清华大学独家Cell子刊文章:细胞迁移关键机制
生物通报道:来自清华大学生命科学院的研究人员发表了题为“Functional Coordination of WAVE and WASP in C. elegans Neuroblast Migration”的文章,揭示了微丝细胞骨架调控因子WAVE和WASP在迁移细胞协同发挥功能的分子机制。
这一研究成果公布在Cell出版社旗下Developmental Cell杂志上,文章的通讯作者是清华大学生科院欧光朔研究员,欧光朔研究组主要以线虫的Q神经前体细胞为对象,研究细胞骨架和信号转导蛋白如何调控神经系统的发育。
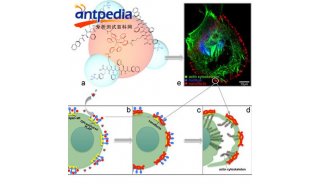
细胞迁移是多细胞动物体发育过程中基本生物学现象,其缺陷可导致个体发育的异常,过度细胞迁移则是癌症转移的重要原因。板状伪足(lamellipodium)是普遍存在于细胞运动前导端的迁移结构,其形成依赖于微丝成核因子Arp2/3复合体在前导端的活化。然而,对于Arp2/3的活性是如何在极性分子的指导下被调控并不清楚。
Arp2/3在胞内的活化依靠其成核促进因子WAVE和WASP。长期以来,WAVE被认为在伪足结构内激活Arp2/3复合体,而WASP参与细胞内吞作用等其他生理过程。
在最新这项研究中,研究人员通过knock-in技术分别对线虫WAVE和WASP蛋白进行原位GFP标记,结合活体成像技术和遗传分析手段,发现在迁移细胞前导端主要存在为WAVE,而WASP也有定位。而且在WAVE缺失的情况下WASP可以从次要存在扩展到前导端大部,弥补原本WAVE的功能,承担Arp2/3复合体的活化调控,继而确保细胞的定向迁移能力。
这项研究以抑制子遗传筛选为基础,结合多种生物化学和细胞生物学分析,鉴定指导线虫Q细胞定向迁移的保守膜蛋白MIG-13/LRP12通过SEM-5/WASP和ABL-1/WAVE两条平行的信号途径激活Arp2/3,揭示Q细胞迁移的新机制。
研究人员认为,这项研究发现的调控Q细胞定向迁移的关键因子都具有人类同源蛋白,研究成果可能为哺乳动物神经系统发育指出新的方向,为相关疾病的治疗提供科学依据。
作者简介:
欧光朔
研究员,博导
1994-2001
中国农业大学生物学院,获理学学士、硕士学位
2001-2006
美国加利福尼亚州大学戴维斯分校,获细胞和发育生物学博士学位
2007-2011
美国加利福尼亚州大学旧金山分校/霍华德休斯医学研究院 (HHMI),博士后
2011-2013 中国科学院生物物理研究所,研究员,博士生导师
现任清华大学研究员、博士生导师
主要研究领域与方向
我们以线虫的Q神经前体细胞为对象,研究细胞骨架和信号转导蛋白如何调控神经系统的发育。Q神经前体细胞发育过程包括不对称分裂、长距离迁移、细胞凋亡及神经丝的形成,最终产生触觉神经元和中间神经元。我们建立了活体荧光显微成像方法,在细胞器和分子水平上实时记录Q细胞发育过程。我们发展了对线虫野生型基因组进行条件性基因突变方法,研究Q细胞发育分子机制。
-
项目成果

-
焦点事件

-
科技前沿

-
科技前沿

-
科技前沿
-
焦点事件

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件
-
项目成果
-
焦点事件
-
焦点事件

-
科技前沿