方案7 二维色谱和质谱结合分离多肽混合物:离线方法
| 实验材料 | |
|---|---|
| 试剂、试剂盒 | |
| 仪器、耗材 | |
| 实验步骤 | 一、可溶性酵母蛋白的酶解1.将 1mg 冷冻干燥的可溶性酵母蛋白加入0.5 ml 的变性溶液中,37°C 溶解 15 min。 2.加入 IAA 至终浓度为 50 mmol/L,然后将样品置于暗处 30 mm,室温条件下使半胱氨酸残基烷基化。 3.样品透析:将样品溶液在 100 ml 的透析液中室温透析 lh,以除去盐和低分子量物质。 4.更换透析液,重复步骤③两次。 5.向样品中加人 20ug 胰酶,37°C 孵育 lOmin。 6.用 10 mmol/L Tris-Cl(pH8.5) 将样品稀释 2 倍(至 1.Oml),加入 CaCl2 至终浓度为 1mmol/L。用 pH 试纸验证 pH 值是否在 8 到 9 之间。 若变性液中含 SDS(步骤①),则必须使其在样品液中的终浓度低于 0.1%,以便胰酶有效消化。 7.37°C 条件下胰酶消化过夜。 8.用 2ul 的 TFA 酸化样品以终止消化,用 pH 试纸确证溶液 pH 值低于 3。 也可用其他方法来溶解(步骤①)和消化蛋白质(例如可不加 SDS,使用其他还原剂,若盐浓度很低则不用透析等)。不过在用 SCX 色谱进行多肽分离前,盐终浓度一定要低于 20 mmol/L(包括 Tris-HCl 和蛋白质水解产生的盐),且上样前需确保溶液的 pH<3。若盐浓度高于 20_〇 1/L,可用膜透析(见步骤③和④),或依制造商提供的指导用 Ql8 固相抽提(SPE) 柱(Vydac) 除盐。 二、SCX 色谱柱的准备9.以 SCX 缓冲液和 SCX 色谱柱为基础建立 HPLC 系统。 10.设置柱流速为 200ul/min,获得空白梯度。 用于多肽洗脱的缓冲液 B 在约 5%~35% 的区间应采取平缓梯度(见表 8.12),这样可使净电荷为+2 的多肽片段(为胰酶酶解的主要产物)比线性梯度洗脱有更好的分离效果。 11.检测 SCX 柱的性能 (1)将溶于缓冲液 A 中的 200pmol 多肽标准品加至 SCX 柱上。 (2)用 UV 检测仪检测多肽在 214nm 的吸收。 应能获得 6 个完全分离的且峰宽小于 1min 的洗脱峰。 三、SCX 色谱分离酵母肽混合物12.将酸化的(pH<3) 的酵母酶解多肽样品加到柱上,用缓冲液 A 洗柱 5~10min,直至 UV 检测峰返回基线。 13.开始梯度洗脱,每分钟收集 200ul 洗脱组分。 图 8.44 所示为利用该技术分离 Img 酵母蛋白的洗脱图谱。该技术可以分离多达 5 mg 的多肽,可根据样品量选用更大或更小的柱子。 14通过离心蒸发浓缩样品体积至 50~100ul。 四、SCX 色谱分离组分的 RPC 层析将纳升级的反相色谱毛细管 LC 串联离子阱质谱仪,进行在线检测,其灵敏度最大,可鉴定的多肽最多。串联后,多肽的检测水平可达 1~5 fmol,并且串联质谱的获取速度达 2000 个图谱/h。 15.将一支内径 75 um、长 20 cm 的桂化毛细管拉成针尖。 有很多方法可用于拉制电喷雾的细针。最简单的方法是将一重物(用胶带纸)粘在针上,然后用微火焰将毛细管拉尖。另外,在方案 5 中介绍的激光拉针器也很有效。不过,拉好的针或预装柱也可以买到(例如,NewObjective,Cambridge,Massachusetts)。 16.取一根已拉尖的 75 um 的硅化毛细管,其中填充 5um、200A 的 C18 颗粒,柱床长度 12 cm(填充毛细管的方法详见方案 4 或方案 5)。 毛细管的针尖不仅可以填料,而且还可充当 MS 的电喷雾针。 17.按照下列步骤连接微型四通的 4 个臂: (1)来自 HPLC 的流动相(lOOjul/min); (2)用于分流(50ym 内径 X50 cm) 的限流毛细管;流速 99.7ul/min; (3)一根连接到高压电源(1.8kV) 的金导线; (4)拉尖的纳升级反相毛细管柱(步骤?),流速为 300nl/min。 18.将 HPLC 的流速调至 100u1/min,利用微型四通进行分流,使流向反相层析柱的流速为 300nl/min。 19.取经 SCX 色谱分离的组分 50ul, 离线加压上样(pressure-loadoff-line),每次加样 10 ul 或更多,然后进行梯度洗脱。 20.向 ESI 提交洗脱峰并在离子阱质谱中分析。 MS 以两种模式运行,即 MS 模式(测定多肽离子的 m/z) 和 MS/MS 模式(多肽测序)。 在短短的 1 h 的反相 LC-MS/MS 分析中,数据依赖型的 MS/MS 扫描可进行上千次肽段测序,将从 MS 扫描中所选择测序的多肽设定为「on the fly」,从每个 MS 图谱中选择 5 个肽段进行测序(裂解)。 |
-
科技前沿

-
标准
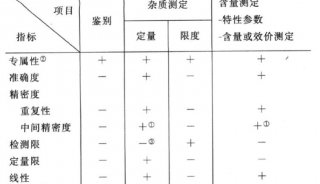
-
招标采购

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
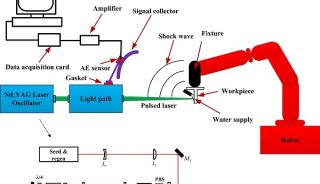
-
技术原理
-
焦点事件
-
产品技术