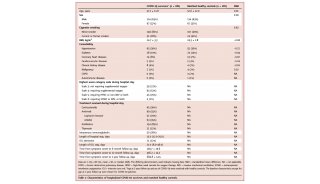
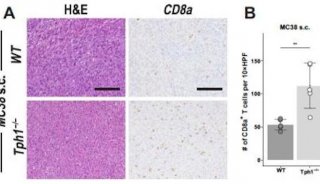
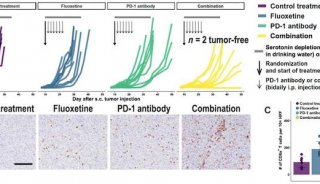
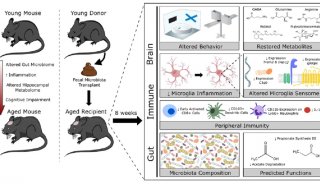
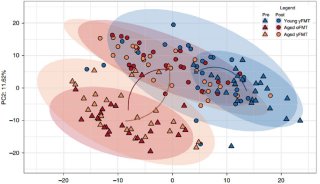
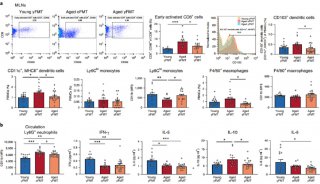
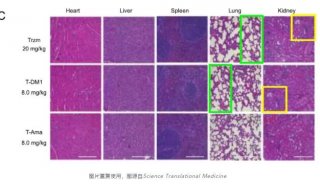
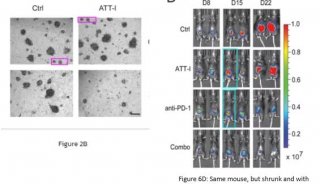
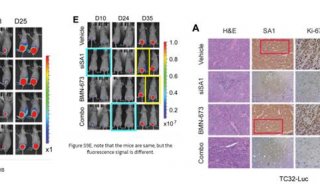
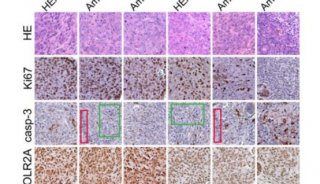
Cell子刊: 人类诱导多能干细胞内在基因组特性
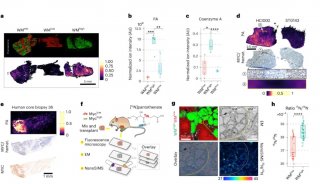
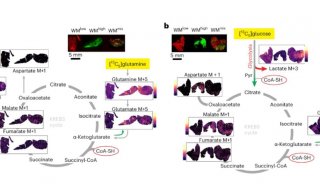
人诱导多能干细胞(Human induced pluripotent stem cells, hipsCs)因其表观异质性而表现出不同的分化潜能,除了印迹和X染色体等研究充分的成分/染色体外,其分化程度/属性尚不清楚。在这里,作者展示了7个不同种系潜力的hipsC株系表现出明显的表观基因组异质性,尽管它们的转录组一致。
近四分之一的常染色体区域具有潜在的差异染色质修饰,H3K27me3/H2AK119ub1的启动子/CpG岛和H3K4me3的进化年轻的反转录转座子。作者鉴定了145个具有差异H3K9me3富集的大常染色体块(R100 kb),其中许多在体细胞中是层相关结构域(lad),而在胚胎干细胞中不是。这些表观基因组的大部分异质性与遗传变异无关。
多能干细胞(PSCs)包括胚胎干细胞(ESCs)和诱导型PSCs(ipsCs),具有强大的自我更新和分化为三层胚层细胞的能力。人类IPSCs(HipsCs)特别有利,因为它们是通过对分化的体细胞进行重新编程而产生的,因此绕过了使用人类胚胎引起的伦理问题。另一方面,hPSC的分化潜能表现出异质性。此前的研究表明,这种异质性与它们的遗传背景和表观基因组状态(包括DNA甲基化状态)的差异有关;然而,对这种异质性的分子基础的了解仍然有限。
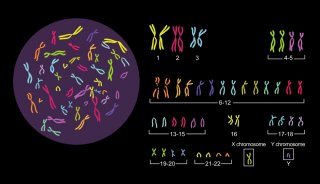
与基因组印记和X染色体失活(XCI)相关的表观遗传异质性(我们使用的术语是指特定的区域/染色体)已经在人类esc (hESCs)和hipsCs中被描述。基因组印记通过亲本等位基因之间调控元件的不同DNA甲基化来调控特定基因(印迹基因)的亲本起源特异性表达;在hPSCs的印记区中,已经观察到亲代特异性DNA甲基化的缺失。XCI通过沉默女性的一条X染色体来补偿两性之间的剂量失衡。
据报道,在人类H9胚胎干细胞中,Xi的抑制性染色质结构分为两类:一类是组蛋白H3赖氨酸27(H3K27me3)的三甲基化富集区,另一类是组蛋白H3赖氨酸9三甲基化富集区(H3K9me3),即组蛋白H3赖氨酸27的三甲基化富集区(H3K27me3)和组蛋白H3赖氨酸9的三甲基化富集区(H3K9me3)。随着XCI侵蚀的进展,H9ESCs中被侵蚀的X染色体(Xe)失去了H3K27me3富集区,同时XIST表达丢失,但保持了在Xi上观察到的H3K9me3富集区。
hipsCs和hESCs的比较分析表明,尽管hipsCs的基因表达和DNA甲基化的全基因组图谱在全球范围内是相似的,但hipsCs的DNA甲基化异常。其中一些差异甲基化区域(DMR)起源于供体细胞(“体细胞记忆”),而另一些则独立于供体细胞,后者可能是在重编程过程中出现的(“重编程相关”)。特别是,全基因组亚硫酸氢盐测序分析显示,非CG低甲基化和H3K9me3在百万碱基范围内显著富集。
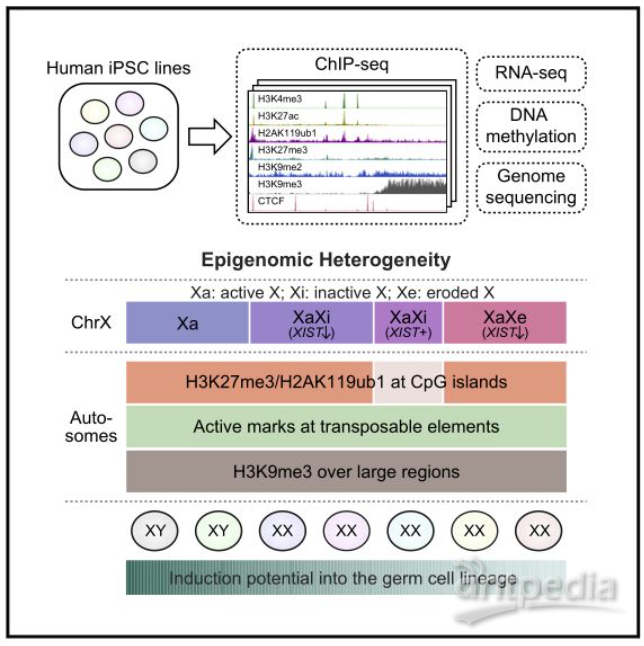
人类诱导多能干细胞表观基因组异质性的内在基因组特性
以前已经显示了hpscs诱导成人类原始生殖细胞样细胞(Hpgclc)的效率的克隆性变异。在先前报道中使用的体外培养系统中,hPSCs首先在激活素和WNT信号的刺激下分化为早期中胚层样细胞(IMeLCs),然后在含有BMP4和其他细胞因子的培养条件下分化为hPGLCs。Hpgclc表现出与活体hpgcs相似的基因表达特性,活体hpgcs是受精后第二周指定的生殖细胞谱系的第一个前体。
在本研究中,作者通过6种组蛋白修饰和一种染色质结合蛋白CCCTC结合因子(CTCF)来了解HipsC系之间的克隆性表观基因组变异的程度。此外,作者还进行了表观基因组变异和pgcl诱导效率之间的关联分析,以了解表观基因组变异对人类生殖细胞分化过程中基因调控的可能影响。
-
项目成果

-
项目成果

-
企业风采

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
项目成果
-
科技前沿

-
项目成果

-
项目成果

-
项目成果

-
项目成果
-
科技前沿
-
焦点事件

-
项目成果

-
焦点事件
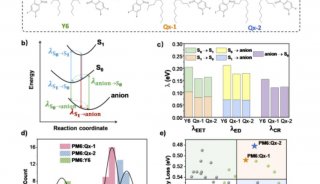
-
科技前沿
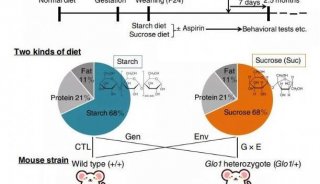
-
项目成果

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿
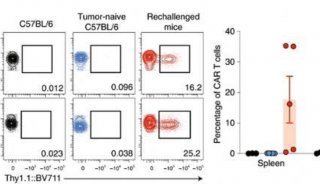
-
项目成果

-
项目成果

-
科技前沿

-
科技前沿

-
科技前沿

-
技术原理
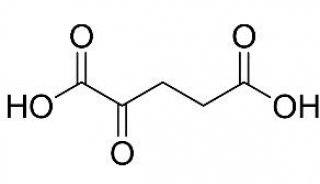
-
项目成果

-
焦点事件

-
项目成果
-
项目成果

-
项目成果

-
项目成果
-
项目成果
-
项目成果

-
项目成果
-
项目成果
-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
项目成果
-
项目成果
-
项目成果

-
综述
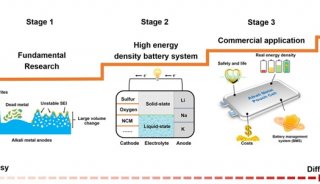
-
项目成果
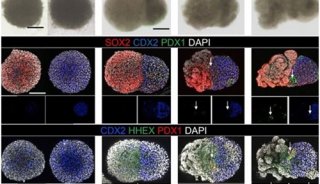
-
项目成果
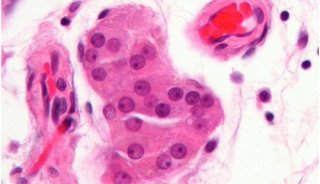
-
项目成果
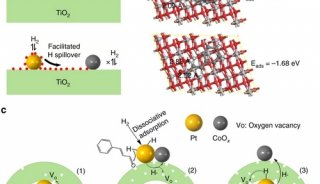
-
项目成果
-
项目成果

-
项目成果

-
项目成果

-
项目成果

-
科技前沿
-
焦点事件
-
项目成果

-
科技前沿

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件
-
科技前沿
-
科技前沿