聚合酶的基本特性
聚合作用
在引物RNA'-OH末端,以dNTP为底物,按模板DNA上的指令由DNApolⅠ逐个将核苷酸加上去,就是DNApolⅠ的聚合作用。酶的专一性主要表现为新进入的脱氧核苷酸必须与模板DNA配对时才有催化作用。dNTP进入结合位点后,可能使酶的构象发生变化,促进3'-OH与5'-PO4结合生成磷酸二酯键。若是错误的核苷酸进入结合位点,则不能与模板配对,无法改变酶的构象而被3'-5'外切酶活性位点所识别并切除之。
3'5'外切酶活性──校对作用
这种酶活性的主要功能是从3'→5'方向识别和切除不配对的DNA生长链末端的核苷酸。当反应体系中没有反应底物dNTP时,由于没有聚合作用而出现暂时的游离现象,从而被3'→5'外切酶活性所降解。如果提高反应体系的温度可以促进这种作用,这表明温度升高使DNA生长链3'末端与模板发生分离的机会更多,因而降解作用加强。当向反应体系加入dNTP,而且只加放与模板互补的上述核苷酸才会使这种外切酶活性受到抑制,并继续进行DNA的合成。由此推论,3'→5'外切酶活性的主要功能是校对作用,当加入的核苷酸与模板不互补而游离时则被3'→5'外切酶切除,以便重新在这个位置上聚合对应的核苷酸。在某些T4噬菌体突变株中DNA复制的真实性降低,而易发生突变,从此突变株分离得到的聚合酶的3'→5'外切酶活性很低。相反,另外一些具有抗突变能力的T4突变株中的聚合酶的3'→5'外切酶活性比野生型高得多,因此,其DNA复制真实性好,变异率低。可见,3'→5'外切酶活性对DNA复制真实性的维持是十分重要的。
5'3'外切酶活性──切除修复作用
5'→3'外切酶活性就是从5'→3'方向水解DNA生长链前方的DNA链,主要产生5'-脱氧核苷酸。这种酶活性只对DNA上配对部份(双链)磷酸二酯键有切割活力作用,方向是5'→3'。每次能切除10个核苷酸,而且DNA的聚合作用能刺激5'→3'外切酶活力达10倍以上。因此,这种酶活性在DNA损伤的修复中可能起着重要作用。对冈崎片段5'末端DNA引物的去除依赖此种外切酶活性。
焦磷酸解作用
DNApolⅠ的这种活性可以催化3'末端焦磷酸解DNA分子。这种作用就是无机焦磷酸分解DNA生长链,可以认为是DNA聚合作用的逆反应,而且这种水解DNA链作用需要有模板DNA的存在。(dNMP)n XPPi←(dNMP)n-x X(dNPPP)→DNA
焦磷酸交换作用
催化dNTP末端的PPi同无机焦磷酸的交换反应。反应式为32P32Pi dNPPP←dNP32P32P PPi→DNA
最后两种作用,都要求有较高浓度的PPi,因此,在体内由于没有足够高的PPi而无重要意义。DNApolⅠ的DNA聚合酶活性和5'→3'外切酶活性协同作用,可以使DNA链上的切口向前推进,即没有新的DNA合成,只有核苷酸的交换。这种反应叫缺口平移(Nicktranslation)。当双链DNA上某个磷酸二酯键断裂产生切口时,DNApoIⅠ能从切口开始合成新的NDA链,同时切除原来的旧链。这样,从切口开始合成了一条与被取代的旧链完全相同的新链。如果新掺入的脱氧核苷酸三磷酸为α-32P-dNTP,则重新合成的新链即为带有同位素标记的DNA分子,可以用作探针进行分子杂交实验。
尽管DNApolⅠ是第一个被鉴定的DNA聚合酶,但它不是在肠杆菌中DNA复制的主要聚合酶。主要证据如下:[1]纯化的DNApolⅠ催化dNTP掺入的速率为667碱基/分,而体内DNA合成速率要比此高二倍数量级;[2]大肠杆菌的一个突变株中,此酶的活力正常,但染色体DNA复制不正常;[3]而在另一些突变株中,DNApolⅠ的活力中只是野生型的1%,但是DNA复制却正常,而且此突变株增加了对紫外线、烷化剂等突变因素的敏感性。这表明该酶与DNA复制关系不大,而在DNA修复中起着重要的作用。
一些特定的DNA聚合酶对于化学修饰性核苷分子显示出惊人的耐受性,从而为高度功能化的核酸分子的有效合成提供了令人激动的新机遇。
-
技术原理
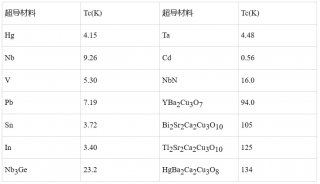
-
科技前沿

-
科技前沿
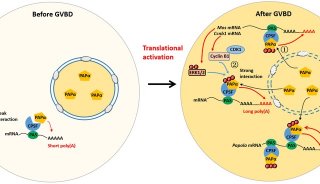
-
技术原理
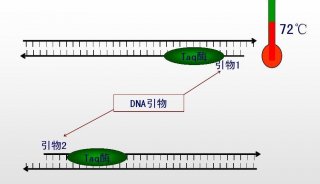
-
综述
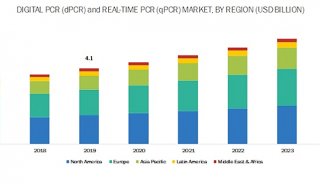
-
技术原理