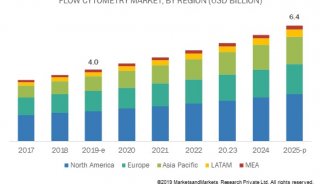
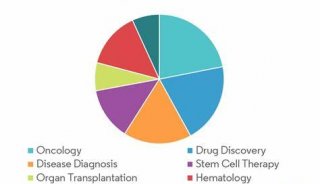
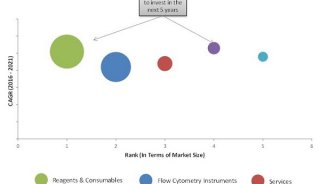
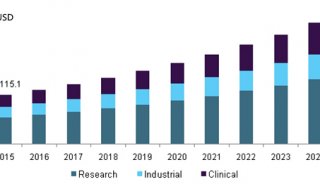
流式细胞仪的使用(个人体会)
相关专题
实验室的CT-流式细胞仪
流式细胞仪(flow cytometry,FCM)是集激光技术、电子技术、光电测量技术、计算机技术以及细胞荧光 技术、单克隆抗体技术为一体的新型高科技仪器,具有灵敏度高、重复性好、特异性强、方法灵活、分析速度快等优点。我院自2000~2002年用美国BD公司生产的FACSC-ALIBUR流式细胞仪,结合科研医疗开展了淋巴细胞亚群(CD3、CD4、CD8、CD19、CD56)分析、白血病免疫分型、DNA分析、活化淋巴细胞CD25的测定、CD34动态监测等的临床和科研项目。现将使用流式细胞仪的体会总结如下。
一、流式细胞仪 的基本用途
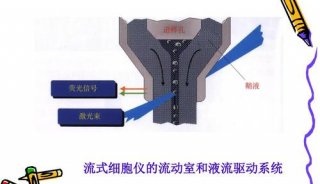
流式细胞 仪可以同时检测单个细胞的多种细胞参数。
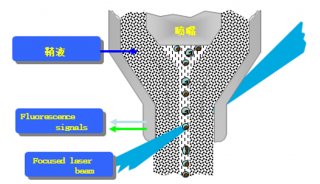
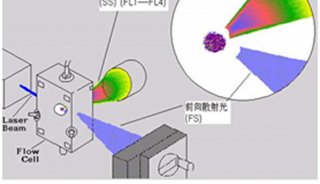
1.内部参数:前向角光散射(FSC)显示细胞的大小,侧向角光散射(SSC)显示细胞质的颗粒性。从内部参数可了解细胞的大小、形态、细胞质的颗粒性、色素含量等。
2.外部参数:对细胞的某一待测成分进行特异性荧光标记后进行检测,包括DNA成分及含量、RNA含量、细胞表面和细胞内的各种抗原、细胞功能活性检测等,分析范围很广且特异性强。流式细胞仪能以每秒钟数十、数百、数千个细胞的速率进行检测,测定的细胞总数可达数千、数万,使得样本能在较短时间内得到全面和准确结果。
二、样本的采集和单细胞悬液制备的质量控制
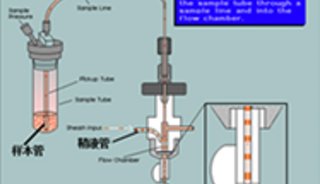
用于流式细胞分析的样本须是单细胞悬液。
1.血液、骨髓是天然的单细胞悬液,可直接染色分析。标本用肝素抗凝,需在6小时内进行抗体标定染色,时间过长,细胞活性降低,影响分析结果,48小时后的标本无分析意义。有些试验以某一群细胞为检测对象,须将所测细胞成分分离出来。本院常用淋巴细胞分离液分离淋巴细胞,制成单细胞悬液。
2.实体组织标本单细胞悬液的制备:取手术切除的新鲜组织的可疑部分用眼科镊夹取小块组织置钢网上轻轻擦磨,同时用PBS缓冲液冲洗,收集冲洗下的单细胞悬液,调细胞浓度至lxl06/ml,经150目尼龙膜过滤、离心,取沉淀物加70%乙醇固定备用。应注意在钢网上擦磨的过程中,用力要适当,用力过大,对细胞损伤较大,产生大量细胞碎片,影响分析。
三、单细胞悬液荧光染色的质量控制
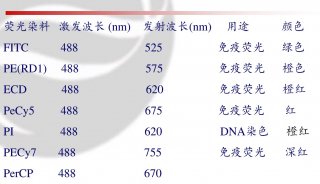
荧光染色对流式细胞分析关系重大,我科使用的荧光染料有:PE、FTTC、cychrome、PI等,操作时将标本和染色剂加人试管底部,混匀,避光(光亮可造成荧光淬灭),室温放置20分钟,如室温过低影响染料结合,可适当延长染色时间。血液、骨髓标本染色后经溶血、洗涤、固定过程即可上机。应注意标本和试剂用量很少,不应加到试管壁上,防止标本和试剂不能充分接触着色。溶血一定要充分,没有完全溶解的红细胞及碎片的存在影响检测分析。
四、上机检测分析的质量控制
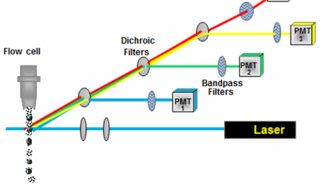
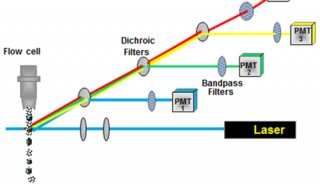
上机获取前使用BD公司提供的质控微球(calibrate bends)来设置和调节仪器的各种参数于最佳状态,如设置光电倍增管(PMT)电压,调节荧光补偿,检测探测器的灵敏度,使仪器的变异系数(CV值)在2%以内。
每一个标本都需同时做一个阴性对照管,由于质控微球和细胞有着不同的光学性质,上述的仪器设置对于生物体标本不一定是最合适的,因此还要用空白标本来调节仪器,使其进一步优化。同时,对空白对照管进行图像分析,可以了解是否有可能导致错误结果的非特异性染色的存在。获取分析时小心观察设门情况,即把要分析的细胞设置在门内,尽量减少其他细胞和碎片的掺人,获取细胞数(每个试验要求不同)要足够。
-
招标采购

-
企业风采

-
市场商机

-
企业风采

-
招标采购

-
招标采购

-
产品技术

-
焦点事件

-
招标采购

-
招标采购

-
投融资

-
焦点事件

-
产品技术

-
焦点事件
-
企业风采

-
综述
-
技术原理

-
招标采购

-
企业风采

-
综述
-
招标采购

-
产品技术

-
焦点事件

-
焦点事件