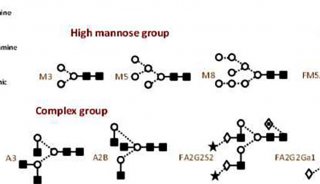
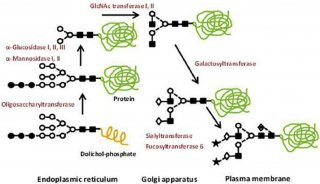
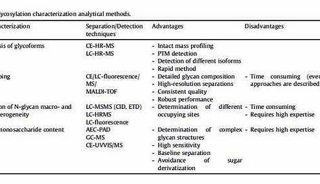
组蛋白的Triton/乙酸/尿素聚丙烯酰胺凝胶电泳分析实验
实验方法原理
试剂、试剂盒 冰醋酸TEMED (NNN’N’-四甲基乙二胺)尿素10% 过硫酸铵(APS; 配胶时新鲜配置)10%
Triton X-100 (蛋白级;Calbiochem)63. 5% 丙烯酰胺 0. 4% 亚甲双丙烯酰胺电泳缓冲液(0.9 mol L
乙酸)还原剂(2-巯基乙胺)
仪器、耗材 抽滤瓶制胶装置适合 16 cm×22 cm 玻璃板的垂直板电泳装置有两条导线可提供恒电流电泳的电源1.5 mm 厚 16 齿梳带有 23-G 针头的一次性注射器带有弯曲为 U 型的 18-G 针头的一次性注射器Hamilton 注射器
实验步骤
1. 在 1000 ml 抽滤瓶中加入:
3.62 ml 冰醋酸
1.88 ml 水
0.329 ml TEMED
2. 轻轻地旋转摇动混合,然后加入:
44. 21 ml 9. 5 mol/L 尿素
0.875 ml 10% APS
3. 将溶液完全抽气。
4. 在瓶中加入 2.59 ml 10% Triton X-100,抽气几秒钟。
5. 在 100 ml 抽滤瓶中加入 16. 5 ml 63. 5% 丙烯酰胺/0. 4% 亚甲双丙烯酰胺。抽气前将抽滤瓶置于盛有适中温度水(约 45℃)的烧杯中。
6. 丙烯酰胺溶液抽气,在温水浴中持续旋转防止丙烯酰胺沉淀。直到大量的小泡完全消失为止(抽气时间不宜过长)。
7. 将抽气后的 Triton X-100/尿素溶液倒入丙烯酰胺瓶中,轻摇混匀。
8. 事先在可重复封装的塑料袋中装好凝胶装置,立即将凝胶溶液倒入。灌胶到距顶部还有 1~1.5 cm 处,在两块板之间插入 1.5 mm 厚 16 齿梳直至凝胶溶液上升到梳齿的一半以上的位置。在以下的 30~60 min 内,凝胶凝聚时要密切观察凝胶的情况,不断地向内推动梳,使梳齿的底端的表面与聚合孔接触。
9. 封好塑料袋(在袋子底部加入少量蒸馏水以防止凝胶干燥),让凝胶凝聚过夜。
10. 小心地将聚合的胶从塑料袋中取出并去掉底部的衬条。将凝胶板装入凝胶电泳装置中,带有凹槽的板朝向上层缓冲液。将凝胶板置于上槽垫圈上方,用 5 cm 宽的装订夹夹紧使之固定在装置上以确保密封。
11. 在两个槽中都加好电泳缓冲液。使用一次性注射器的弯曲为 U 型的 18-G 针头将凝胶底部表面的气泡赶走。轻轻拔下梳齿,小心地使用一次性注射器的针头(23-G 针头)将弯曲的加样孔间隔扶正。使用同一个注射器用电泳缓冲液冲洗加样孔。
12. 将凝胶与电源相连。在电泳缓冲液中以 130V (恒电压)进行预电泳,直到电流不再下降为止(大约 4~5 h)。在这段时间里,要定期的切断电源,使用注射器(带有 23-G 针头)用电泳缓冲液冲洗加样孔。同时使用一次性注射器的弯曲为 U 型的18-G 针头将聚集在凝胶底部表面的气泡赶走。
13. 去除凝胶装置两个槽中的电泳缓冲液。在上槽中加入水并冲洗加样孔。将上槽中的水倒出,并使用带有 23-G 针头的一次性注射器将加样孔中的水除净,小心不要使注射器的针头刺破加样孔的底部。
14. 使用 1 ml 移液管将还原剂均匀地加满加样孔。在上槽中缓慢地加入电泳缓冲液,当缓冲液开始进入加样孔时要更加的小心;电泳缓冲液应该将还原剂覆盖住。在下槽中加入缓冲液并于 300 V 电泳 3 h。
15. 重复步骤 10。
16. 在两个槽中都加好新鲜的电泳缓冲液并用吸有电泳缓冲液的注射器冲洗加样孔。用 Hamilton 注射器将样品(通常 2~6 ul;50~75 ug 组蛋白)加入加样孔,使样品直接铺于加样孔的底部。在每个样品上样前,都要用吸有电泳缓冲液的注射器冲洗加样孔以除去尿素沉积。
17. 400V 电泳 15 min。然后降低电压至 200V 电泳直到蓝色染料中的甲基绿跑出凝胶为止(过夜,或 15~17 h),或更长。
18. 凝胶进行考马斯亮蓝染色或电转后进行免疫印迹反应观察。
-
会议会展
-
企业风采

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
项目成果