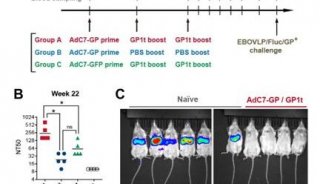
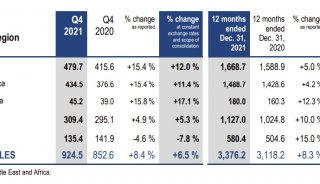
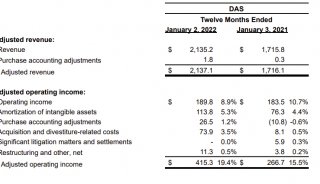
EMBO J:鉴定出几种削弱埃博拉病毒感染的宿主蛋白

埃博拉病毒(Ebola virus),1976年在扎伊尔和苏丹首次发现,会引起人体大量内出血,造成病人休克甚至死亡。埃博拉病毒是一种属于丝状病毒家族的RNA病毒病原体,导致人类严重疾病的爆发。这种公共卫生威胁导致了疫情暴发,报告的病死率高达90%。
2013-2016年的西非埃博拉病毒疫情导致超过28000人感染和超过11000人死亡。2017-2021年在刚果民主共和国爆发了四次疫情,2021年埃博拉病毒在几内亚重新出现。
在一项新的研究中,来自美国乔治亚州立大学的研究人员在宿主身上发现了几种与埃博拉病毒相互作用的蛋白质,其主要功能是抑制细胞中病毒遗传物质的产生和阻止埃博拉病毒感染。相关研究结果于2021年8月2日在线发表在EMBO Journal期刊上,论文标题为“Non-canonical proline-tyrosine interactions with multiple host proteins regulate Ebola virus infection”。
这些作者在这项研究中发现与其他富含脯氨酸的基序相比,埃博拉病毒VP30蛋白通过采用非典型取向的PPxPxY基序与病毒核蛋白(NP)和宿主蛋白RBBP6相互作用。亲和标签-纯化质谱法确定了其他含有PPxPxY的宿主蛋白hnRNP L、hnRNPUL1和PEG10也与VP30相互作用。hnRNP L和PEG10与RBBP6一样,抑制病毒RNA合成和埃博拉病毒感染,而hnRNPUL1起着相反的作用,会增强病毒RNA合成和埃博拉病毒感染。
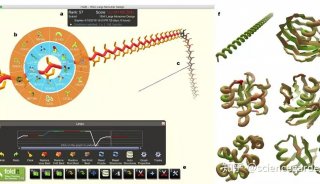
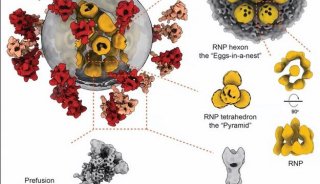
蛋白定位研究发现了多种具有PPxPxY基序的与VP30相互作用的宿主蛋白,包括RBBP6、hnRNP L、hnRNPUL1和PEG10。RBBP6和hnRNP L可阻止VP30-NP相互作用,抑制VP30去磷酸化,抑制病毒RNA合成。图片来自The EMBO Journal, 2021, doi:10.15252/embj.2020105658。
RBBP6和hnRNP L调节VP30的磷酸化,增加病毒转录,并对病毒的RNA合成产生相加效应。PEG10对埃博拉病毒复制的抑制作用较为温和。hnRNPUL1对病毒RNA合成有积极影响,但与VP30无关。结合研究表明,这些蛋白的PPxPxY基序与VP30结合的能力各不相同,并确定PxPPPPxY为最佳的结合基序,此外还确定这个基序中的酪氨酸和第五个脯氨酸对相互作用最为关键。竞争结合和氢氘交换质谱研究表明,每种蛋白都与VP30上的一个类似界面结合。因此,VP30具有一种新的脯氨酸识结构域,该结构域被多种宿主蛋白靶向识别和结合来调节病毒转录。
论文通讯作者、乔治亚州立大学生物医学研究所微生物发病机制中心主任Christopher Basler教授说,“这些发现是了不起的,因为我们通常认为埃博拉病毒在受感染的人体内不受控制地生长。我们的数据显示,我们的细胞含有多种靶向同一病毒界面的蛋白质,以减缓病毒的基因表达和复制。我们希望这些发现将使我们能够开发出预防或治疗埃博拉病毒感染的新方法。”
参考资料:
Jyoti Batra et al. Non‐canonical proline‐tyrosine interactions with multiple host proteins regulate Ebola virus infection. The EMBO Journal, 2021, doi:10.15252/embj.2020105658.
-
科技前沿
-
焦点事件

-
企业风采

-
企业风采

-
财报

-
科技前沿

-
科技前沿

-
焦点事件

-
焦点事件

-
招标采购
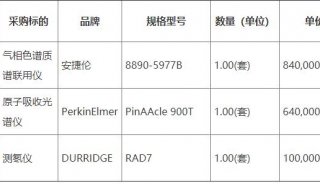
-
企业风采

-
产品技术
-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
财报

-
企业风采

-
企业风采

-
焦点事件

-
企业风采

-
并购

-
焦点事件

-
企业风采

-
并购

-
财报

-
焦点事件

-
焦点事件

-
企业风采

-
财报

-
企业风采

-
并购

-
企业风采

-
企业风采

-
企业风采

-
企业风采

-
焦点事件

-
招标采购

-
项目成果
-
精英视角

-
企业风采

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
并购

-
项目成果