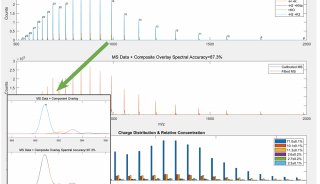
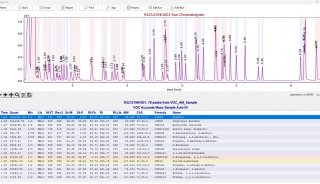
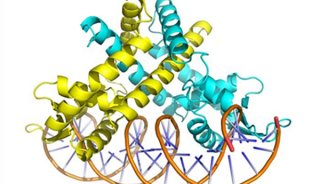
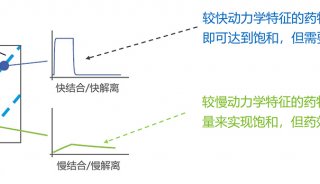
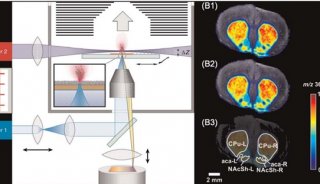
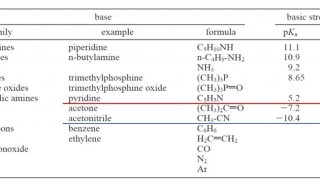
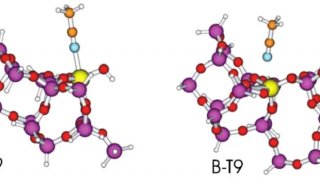
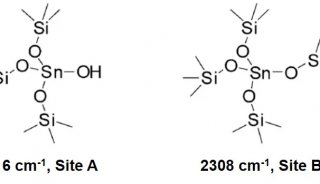
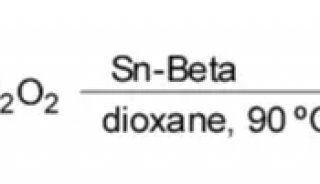同核双原子分子分子轨道电子排布式
(1)




(2)




(3)





(4)
其电子排布式为:
最后2 个电子进入






-
企业风采

-
市场商机

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
企业风采

-
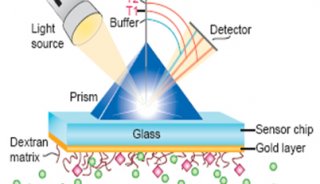
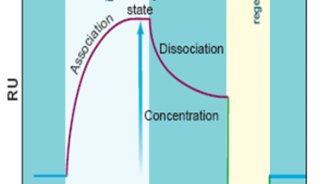
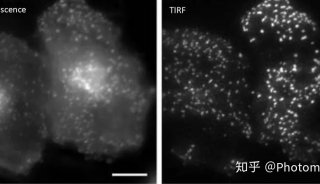
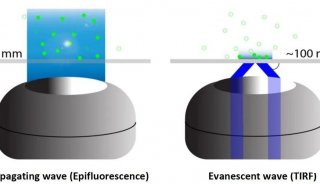
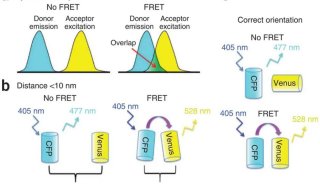
技术原理
-
企业风采

-
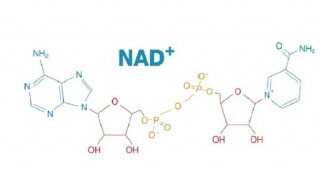
科技前沿
-
焦点事件

-
焦点事件

-
精英视角

-
企业风采

-
焦点事件

-
企业风采

-
焦点事件

-
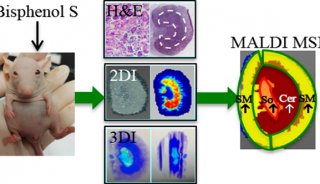
项目成果
-
企业风采