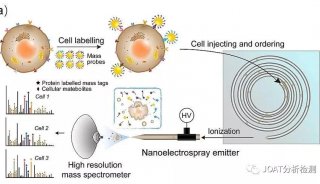
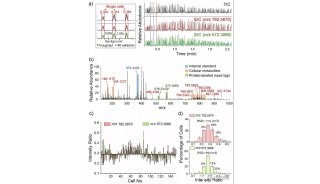
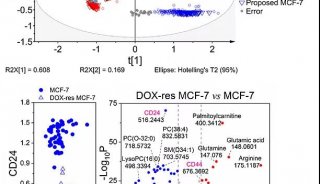
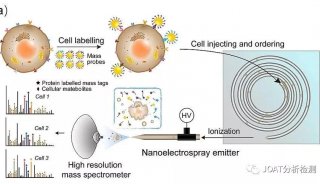
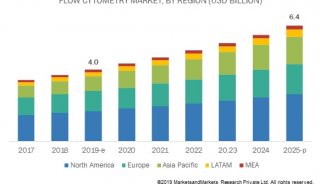
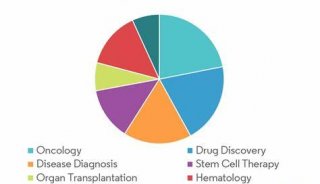
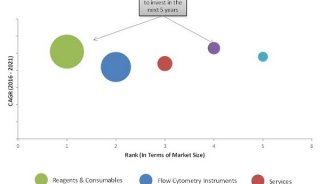
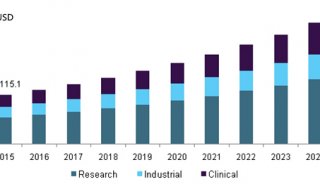
流式细胞技术精彩回顾
分子生物学主要致力于对细胞中不同系统之间相互作用的理解,包括DNA,RNA和蛋白质生物合成之间的关系以及了解它们之间的相互作用是如何被调控的。而流式细胞仪是测量液相中悬浮细胞或微粒的一种现代分析技术。与传统的荧光镜检查相比,具有速度快、精度高、准确性好等优点。
技术简介
流式细胞术(Flow Cytometry, FCM)是一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的检测手段,它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数,是一种在液流系统中,快速测定单个细胞或细胞器的生物学性质,并把特定的细胞或细胞器从群体中加以分类收集的技术。其特点是通过快速测定库尔特电阻、荧光、光散射和光吸收来定量测定细胞 DNA含量、细胞体积、蛋白质含量、酶活性、细胞膜受体和表面抗原等许多重要参数。根据这些参数将不同性质的细胞分开,以获得供生物学和医学研究用的纯细胞群体。目前最高分选速度已达到每秒钟3万个细胞。
工作原理
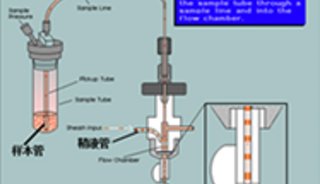
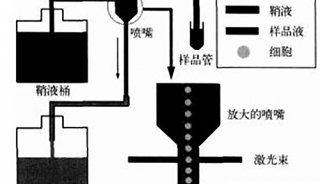
将待测细胞染色后制成单细胞悬液。用一定压力将待测样品压入流动室,不含细胞的磷酸缓冲液在高压下从鞘液管喷出,鞘液管入口方向与待测样品流成一定角度,这样,鞘液就能够包绕着样品高速流动,组成一个圆形的流束,待测细胞在鞘液的包被下单行排列,依次通过检测区域。
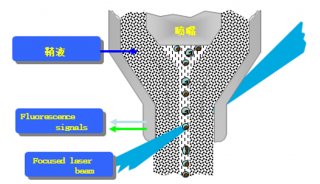
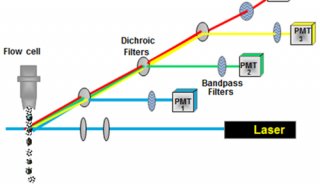
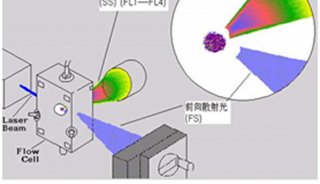
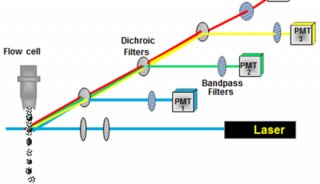
流式细胞仪通常以激光作为发光源。经过聚焦整形后的光束,垂直照射在样品流上,被荧光染色的细胞在激光束的照射下,产生散射光和激发荧光。这两种信号同时被前向光电二极管和90°方向的光电倍增管接收。光散射信号在前向小角度进行检测,这种信号基本上反映了细胞体积的大小;荧光信号的接受方向与激光束垂直,经过一系列双色性反射镜和带通滤光片的分离,形成多个不同波长的荧光信号。
这些荧光信号的强度代表了所测细胞膜表面抗原的强度或其核内物质的浓度,经光电倍增管接收后可转换为电信号,再通过模/数转换器,将连续的电信号转换为可被计算机识别的数字信号。计算机把所测量到的各种信号进行计算机处理,将分析结果显示在计算机屏幕上,也可以打印出来,还可以数据文件的形式存储在硬盘上以备日后的查询或进一步分析。
检测数据的显示视测量参数的不同由多种形式可供选择。单参数数据以直方图的形式表达,其X轴为测量强度,Y轴为细胞数目。一般来说,流式细胞仪坐标轴的分辨率有512或1024通道数,这视其模数转换器的分辨率而定。对于双参数或多参数数据,既可以单独显示每个参数的直方图,也可以选择二维的三点图、等高线图、灰度图或三维立体视图。
细胞的分选是通过分离含有单细胞的液滴而实现的。在流动室的喷口上配有一个超高频电晶体,充电后振动,使喷出的液流断裂为均匀的液滴,待测定细胞就分散在这些液滴之中。将这些液滴充以正负不同的电荷,当液滴流经带有几千伏特的偏转板时,在高压电场的作用下偏转,落入各自的收集容器中,不予充电的液滴落入中间的废液容器,从而实现细胞的分离。
发展历程
流式细胞仪从细胞技术开始发展到今天,60年代至70年代是其飞速发展时期。 激光技术、喷射技术以及计算机的应用使流式细胞仪在原理和结构上形成了固定的模式。
80年代则是流式细胞仪的商品化时期,这期间不断有新型号的仪器推出,在多参数检测技术上不断提高。
进入90年代,随着微电子技术特别是计算机技术的发展,计算能力不断提高,流式细胞仪的功能也越来越强大。在数据管理、数据分析方面有了长足进步。但是,在技术原理和设计方面并没有突破性的进展。人们的注意力开始转向流式细胞仪的应用,新的荧光探针、新的荧光染料、新的染色方法不断推出,使流式细胞技术在新的细胞参数分析方面日益发展。
从新推出的仪器看,流式细胞仪会在硬件上不断更新,采用更新的器件(如半导体激光、大规模集成电路),以实现小型化;用数字电路取代模拟电路,充分发挥微处理器的功能以实现简单化;在软件上提高数据自动分析能力,充分发挥图形界面的优点,使操作更加简便。
技术应用
随着对FCM研究的日益深入,其价值已经从科学研究走入了临床应用阶段,在我国临床医学领域里已有着广泛的应用。可用于白血病的分型、肿瘤细胞染色体的异倍性测定,以及免疫学研究,并已开始用于细菌鉴定,病毒感染细胞的识别和艾滋病感染者T4、T8细胞的记数。
自70年代以来,随着流式细胞技术水平的不断提高,其应用范围也日益广泛。流式细胞术已普遍应用于免疫学、血液学、肿瘤学、细胞生物学、细胞遗传学、生物化学等临床医学和基础医学研究领域。
在肿瘤学中的应用
这是FCM在临床医学中应用最早的一个领域。首先需要把实体瘤组织解聚、分散制备成单细胞悬液,用荧光染料(碘化吡啶PI)染色后对细胞的DNA含量进行分析,将不易区分的群体细胞分成三个亚群(G1期,S期和G2期),DNA含量直接代表细胞的倍体状态,非倍体细胞与肿瘤恶性程度有关。
(1)发现癌前病变,协助肿瘤早期诊断:人体正常组织发生癌变要经过一个由量变到质变的漫长过程,而癌前细胞即处于量变过程中向癌细胞转化阶段。人体正常的体细胞均具有比较稳定的DNA二倍体含量。当人体发生癌变或具有恶性潜能的癌前病变时,在其发生、发展过程中可伴随细胞DNA含量的异常改变,FCM可精确定量DNA含量的改变,作为诊断癌前病变发展至癌变中的一个有价值的标志,能对癌前病变的性质及发展趋势作出估价,有助于癌变的早期诊断。有资料证实,癌前病变的癌变发生率与细胞不典型增生程度有密切关系,增生程度越重,癌变发生率越高。随着细胞不典型增生程度的加重,DNA非整倍体出现率增高,这是癌变的一个重要标志。
(2)在肿瘤的诊断、预后判断和治疗中的作用:FCM在肿瘤诊断中的重要作用已经被认可,DNA非整倍体细胞峰的存在可为肿瘤诊断提供有力的依据,FCM分析病理细胞具有速度快、信息量大,敏感度高等优点,已被用在常规工作中。肿瘤细胞DNA倍体分析对病人预后的判断有重要作用,异倍体肿瘤恶性病变的复发率高、转移率高、死亡率也高,而二倍体及近二倍体肿瘤的预后则较好。
FCM不仅可对恶性肿瘤DNA含量进行分析,还可根据化疗过程中肿瘤DNA分布直方图的变化去评估疗效,了解细胞动力学变化,对肿瘤化疗具有重要的意义。临床医师可以根据细胞周期各时相的分布情况,依据化疗药物对细胞动力学的干扰理论,设计最佳的治疗方案,从DNA直方图直接地看到瘤细胞的杀伤变化,及时选用有效的药物,对瘤细胞达到最大的杀伤效果。
此外FCM近几年还被应用于细胞凋亡和多药耐药基因的研究中。医学工作者开始研究如何用药物诱导癌细胞死亡。通过对细胞体积、光散射、DNA含量及特异性抗原基因(如bcl-2, Fas等)测定分析出细胞凋亡情况。多药耐药是肿瘤病人化疗失败的主要原因,FCM对多药耐药基因(P170等)和凋亡抑制基因及凋亡活化基因表达的测定,可为临床治疗效果分析提供有力依据。
在血液病诊断和治疗中的应用
FCM通过对外周血细胞或骨髓细胞表面抗原和DNA的检测分析,对各种血液病的诊断、预后判断和治疗起着举足轻重的作用。
(1)白血病的诊断和治疗:FCM采用各种抗血细胞表面分化抗原(CD)的单克隆抗体,借助于各种荧光染料(异硫氰基荧光素FITC,藻红蛋白PE等)测定一个细胞的多种参数,以正确地判断出该细胞的属性。各种血细胞系统都具有其独特的抗原,当形态学检查难以区别时,免疫表型参数对各种急性白血病的诊断和鉴别诊断有决定性作用。
同其它肿瘤的治疗一样,测定DNA倍体和进行细胞周期分析对指导白血病化疗有一定作用,不同的白血病患者或同一患者在不同病期白血病细胞增殖状况不同,定期了解细胞增殖情况采取相应药物可以提高疗效。
目前临床除化疗药物治疗外还采用造血干细胞移植技术治疗急性白血病和一些疑难性疾病。FCM通过对人白细胞抗原(HLA)配型的测定可以为异体干细胞移植病人选择出最合适的供体。造血干细胞移植技术主要包括干细胞的鉴别、活性测定、干细胞动员和采集、分离纯化、保存扩增、肿瘤细胞的净化、干细胞回输以及术后保持移植物抗宿主病的低发生率等一系列过程。FCM测定CD34、HLA-DR、CD33等细胞表面标志物,成为干细胞移植技术重要的监测手段。用FCM检测一系列指标观察病人的恢复状态,可以对预后做出早期的判断。
(2)其它种类血液病的诊断和治疗监测:阵发性睡眠性血红蛋白尿症是一种造血干细胞克隆病,细胞CD55、CD59抗原表达减低是该病的一个特点。该抗原属于血细胞表面磷脂酰肌醇锚连蛋白家族,是重要的补体调节蛋白,它通过与补体C8、C9的结合以阻止补体膜攻击复合物的形成,从而抑制细胞被补体激活溶解。FCM采用荧光标记的单克隆抗体对血细胞CD59的表达做定量分析,可以协助临床做出诊断并判断疾病的严重程。
(3)网织红细胞的测定及临床应用:网织红细胞计数是反映骨髓造血功能的重要指标,FCM通过某些荧光染料(吖啶橙、噻唑橙等)与红细胞中RNA结合,定量测定网织红细胞中RNA,得到网织红细胞占成熟红细胞的百分比。有作者报道FCM方法比目测法结果精确度更高。此外FCM还可以测量出网织红细胞的成熟度,对红细胞增殖能力的判断很有意义。为干细胞移植术后恢复的判断、贫血的治疗监测、肿瘤病人放化疗对骨髓的抑制状况等提供了依据。
在血栓与出血性疾病中的应用
(1)血小板功能的测定:正常情况下血小板以分散状态在血管内运行,但当血管损伤、血流改变或受到化学物质刺激时血小板被活化而发生一系列改变。由于血小板的活化程度可由血小板膜糖蛋白表达水平的高低来判断,FCM测定血小板膜糖蛋白的表达情况成为检查血小板功能的一种新手段。该方法灵敏、特异性高。如果采用全血法测定,只需微量标本,适合于儿童及血小板减少性疾病的患者。血小板活化时其质膜糖蛋白较其静止期发生显著改变,FCM可以通过单抗免疫荧光标记(血小板膜糖蛋白Ⅱb/Ⅲa,CD62,CD63等)监测血小板功能及活化情况,有利于血栓栓塞性疾病的诊断和治疗。此外血小板活化时其细胞内的钙离子浓度发生很大变化,借助于钙离子敏感荧光探针的帮助,用FCM测定钙离子浓度,可以作为活化血小板监测的非免疫性指标。
(2)血小板相关抗体的测定:免疫性血小板减少性紫癜病人血浆中可产生血小板自身抗体,结合在血小板表面,称为血小板相关抗体,其分子可以是IgG、IgA或IgM,用羊抗人IgG、IgA、IgM荧光抗体标记被测血小板,FCM可以测定血小板相关抗体含量。直接法检测血小板表面的相关抗体,间接法可测定血清中的相关抗体。该方法用于该病的诊断及治疗监测,具有检测速度快、灵敏度高的优点。
未来展望
流式细胞技术
目前,FCM是定量外周血中HPC的参考方法,广泛应用于外周血干细胞移植实验室,用于决定PBSC采集的时机及评价外周血采集液的收益。其基本原理为荧光免疫分析,即根据外周血与骨髓中HPC表达同样的CD34抗原(CD34+),并利用荧光标记CD34抗体与HPC膜表面CD34抗原结合,在特定波长的激光照射下,检测CD34+胞发出的荧光强度并结合其光学特性,即较低的侧向散射(SSC)和较高的前向散射(FSC),从而检测CD34+细胞。CD34+细胞实际上包括所有的HPC,如CFU-GM,红细胞暴发形成单位(BFU-E),巨核细胞形成单位(CFU-Mk),混合细胞集落形成单位(CFU-Mix)和原始细胞集落形成单位(CFU-Blast)。后两种HPC明显具有许多干细胞的特征,如它们可以自我更新,也可定向分化为一定数目的造血细胞系。体内试验也发现,经过致死剂量照射的狒狒移植足够数量的自体CD34+细胞,可以完全恢复其造血功能,同样的现象也可在经过骨髓、摧毁性治疗的病人中出现。有人认为,CD34+细胞在功能上可根据是否表达CD33抗原而分为2个细胞群。早期的HPC,如CFU-Blast和LTC-IC仅表达Q CD34抗原(CD34+/CD33-),而较为成熟的定向祖细胞可同时表达CD34和CD33抗原(CD34+/CD33+)。还有人根据CD38抗原表达与否,将CD34+细胞分为CD34+/CD38-和CD34+/CD38+两个亚型,并且认为LTC-IC主要分布于CD34+/CD38-亚型,而更为原始的ELTC-IC则仅分布于CD34+/CD28-细胞群,说明CD34+/CD38-亚型性质上更接近PBSC。
回顾性资料表面,移植经历了与移植物中不同分化程度的HPC有关的两个阶段。起初,与早期造血恢复有关的是移植 物中定向祖 细胞(committed progenitor cell);继之,持续性的移植 相由多能造血干细胞产生。因此,周血中不同分化程度的HPC,对指导干细胞采集及移植成功尤为必要。目前多参数及双参数流式细胞低度均可通过CD34、CD33和CD38抗体等检测标本中不 同CD34+细胞亚型,来决定采血的时机和预测移植效果。Barnett等报道,采集液CD34+细胞数量与外周血中CD34+细胞百分率显著相关(r=0.71),并且认为准确计数循环中CD34+细胞,可更好地预测采集液中造血干/祖 细胞含量。Weaver等观察692例患者外周血祖细胞(PBPC)采集液中CD34+细胞、单个核细胞、集落形成单位的数量与移植动力学关系,认为PBPC采集液中CD34+细胞含量是预移植后中性粒细胞和血小板数量回升最有力的指标。
虽然,FCM测定CD34+细胞是检测HPC数量的参考方法,但仍有一些技术问题有待解决:(1)单平台分析代替传统双平台分析的可行性;(2)应对单平台FCM分析实验室进行多中心的横向研究;(3)标本制备方法;(4)确定引起移植后快速和长期造血功能恢复的不同干细胞亚型及移植所需数目等。此外,FCM法需特殊仪器,操作技术要求高,价格昂贵,结果的重复性欠佳,促使人们追求更经济、快捷、简便的方法。
-
招标采购

-
市场商机

-
企业风采

-
招标采购

-
产品技术

-
企业风采

-
焦点事件

-
招标采购

-
企业风采

-
招标采购

-
招标采购

-
焦点事件

-
投融资

-
焦点事件

-
综述
-
产品技术

-
焦点事件
-
综述
-
技术原理

-
企业风采

-
综述
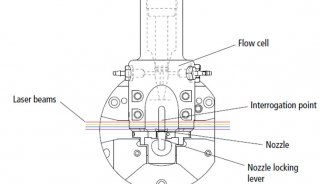
-
产品技术