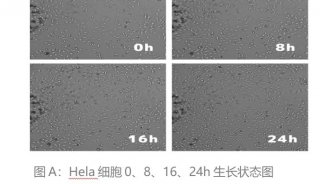
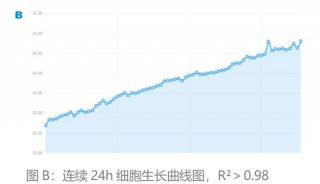
活细胞工作站的应用
一、研究背景
大部分哺乳动物的组蛋白都以序列特异性的方式结合到DNA的连接序列上,连接处的核小体会因此产生高度有序的染色质结构来精确的调节基因的表达。H1foo是卵细胞中特异表达的组蛋白H1家族成员,从减数分裂胚泡期卵母细胞到晚期两细胞胚胎的发展过程中全程表达。而且它的表达对小鼠卵母细胞的成熟所必需的,对卵母细胞向受精卵发育起着促进的作用。H1foo与组蛋白H1家族的其他成员有极低的序列同源性,而且它的功能也知之甚少。
二、实验方法
东京大学的研究者采用转盘式激光共聚焦活细胞工作站(CV1000,日本Yokogawa)观察了通过构建后融合表达GFP蛋白的H1foo的胚胎干细胞细胞系(H1foo-ES),还有用于实验对照的四个细胞系分别是EGFP-ES, H1s-ES,H1e-ES,H1f0-ES,分别表达了GFP, 组蛋白亚型H1s,H1e,H1f0分别和GFP的融合蛋白。
三、实验结果
构建和鉴定情况如下图:

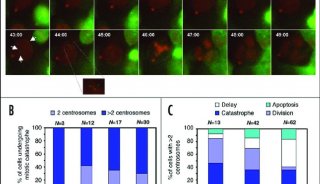
从实验结果(A)我们可以看出,各细胞系的GFP都分布在核内,且在核仁处没有聚集;而且各细胞系的GFP表达量H1foo最低(B),这些外源性的组蛋白与造型的表达也并不影响内源性组蛋白的表达量的变化(B),这些胚胎细胞系中的内源性的组蛋白的mRNA(C)和各个胚胎干细胞标志基因也没有受到影响(D)

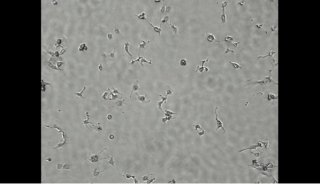
在接下来的实验设计中,研究者发现,H1foo的表达影响了胚胎干细胞的正常分化,相差显微镜图片(A)标明,表达了外援H1foo的细胞系,14天培养后与其他对照组的发育形成了鲜明的对比---发育滞后。接着使用RT-PCR的方法检测各细胞系中(B中U栏)发育各时期标记基因的转录,可帮助我们定位胚胎的7天后发育阶段(B中D栏),检测的基因分别为多能干细胞标志基因(Zfp42, Dppa3, Nanog, Sall4 and Oct4);内胚层标志基因(Gata4, Gata6 and Sox17);中胚层标志基因(Kdr);外胚层标志基因(Nog)。
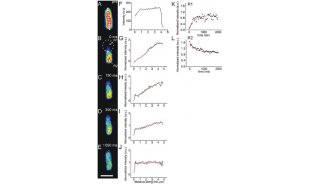
实验结果与显微镜结果一致,H1foo-ES细胞系表现出的多功能干细胞的分子标记物确实比对照组更多,说明H1foo的表达影响了ES细胞的分化。那么如果我们用外源的短发夹RNA(shRNA)干扰细胞内H1foo的转录是否会拯救这种分化的停滞呢?一组可视化的免疫荧光图片(由YOKOGAWA的CV1000共聚焦系统完成)让我们又进一步的验证了这一猜想:我们将转染了shRNA的H1foo-ES细胞系向神经细胞分化方向诱导,10天后,细胞系中神经细胞标志分子TubbIII的表达上调,而多功能干细胞的标志分子明显下降。
四、实验结论
由此我们不难推论,H1foo的异常表达影响了ES细胞的分化潜能。
已有研究报道H1foo基因是受到组织特异的DNA甲基化以及甲基化差异区域(T-DMR)的调控的, 而且在分化后的细胞中,H1foo的表达也严格的受到T-DMR DNA甲基化的抑制。细胞的分化也会改变基因组范围内表观遗传学的特征,包括在T-DMR区域的甲基化以及去甲基化。那么H1foo的上述作用是不是和甲基化已有一定的联系呢?
COBRA甲基化分析实验证实,和上述的对照组相比,H1foo-ES组的甲基化确实在7天后的检测中显示受阻,这也说明了分化的停滞也是伴随着从干细胞到分化状态的甲基化变换的受阻(结果未显示)。而且ChIP实验结果也揭示了在T-DMR区域的高度甲基化和低甲基化位点都有H1foo的相伴,但也有一些高度甲基化的区域并没有H1foo的结合,所以我们只能暂时命名这些H1foo偏好的区域为H1foo靶向区域,其他为非靶向区域。
进一步的研究更让人吃惊,在H1foo靶向的区域内,低度甲基化的核酶敏感性比对照组GFP-ES高,说明这些区域有并不致密的结构。与此同时,在GFP-ES细胞中对核酶敏感的高甲基化区域,在H1foo-ES细胞系中却产生了抗性。而那些非H1foo结合的区域都抗核酶消化。这说明了什么呢?---H1foo参与了核小体位点特异性的定位,因而导致了甲基化的变化。
谜底终于真相大白,这个实验设计中涉及到了很多分子生物学的手段,譬如:RT-PCR,ChIP,COBRA, 唯一的激光共聚焦荧光成像图片成了整篇文章中的可视化亮点。文中提到的YOKOGAWA公司的CV1000系列也是该公司2010年刚推出的转盘式共聚焦的典范,2011年进入中国市场,它不仅可以兼容固定细胞切片,活细胞多时相长时间观察,还可以做活组织切片培养,是目前实验室必不可少的仪器工具之一。
-
企业风采

-
焦点事件
-
招标采购

-
标准

-
科技前沿

-
企业风采

-
科技前沿

-
焦点事件

-
项目成果

-
科技前沿

-
科技前沿

-
技术原理
-
焦点事件

-
科技前沿

-
综述
-
产品技术

-
企业风采

-
项目成果

-
招标采购

-
企业风采