lncRNA具有促进骨形成和治疗骨质疏松的能力
长非编码RNA (IncRNA) 的生物学功能在近年来受到了广泛的关注。作为生物体内数量最多的RNA类型,越来越多的IncRNA被发现可以影响细胞的功能、器官的发育以及多种疾病的发生发展。但是,作为功能复杂的基因转录本,目前对IncRNA在疾病中的功能和作用机制仍然缺乏了解【1】。
随着我国老龄化的加速,50岁以上人群骨质疏松症患病率高达19.2%。成骨细胞分化不足和成骨能力下降是骨质疏松发病的主要原因,但是成骨细胞分化的关键调节机制还有待被揭示。最近,在体外研究系统中,IncRNA被证明参与了成骨细胞的成熟和其前体细胞-间充质干细胞的成骨分化【2】。然而在体内,IncRNA是否能够影响骨代谢,调节骨形成还不清楚。在众多的候选IncRNA中能否发现在体内促进成骨的保守性lncRNA分子,进而能否将lncRNA作为骨质疏松症干预的潜在靶点,是本领域亟待解决的重要问题。
2019年4月8日,来自北京航空航天大学的王晓刚/同济大学的孙瑶、王佐林/暨南大学的张弓合作团队在 Nature Metabolism 杂志以Article形式在线发表了题为The long noncoding RNA lnc-ob1 facilitates bone formation by upregulating Osterix in osteoblasts 的研究论文。据悉,该研究完全由我国学者独立设计,全部研究工作在国内开展和完成。这也是Nature Metabolism杂志首次以中国学者为通讯单位发表的研究类论文。

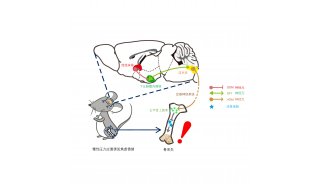
该研究发现了一系列调控成骨细胞分化的保守性lncRNA分子,并重点分析和验证了其中一个新的成骨细胞富集的lncRNA分子(命名为lnc-Ob1),lnc-Ob1能够促进成骨细胞的分化,在小鼠体内显著增强骨形成能力(下图)。
lncRNA发现型研究中常常有两大难点:(1) lncRNA在物种间的低保守性,即相同功能的lncRNA在物种间的序列保守性不高;(2) 许多lncRNA丰度很低,部分序列与已知其他基因高度相似,因此对测序实验和算法精度的要求极高。在最新的这项研究中,研究人员同时利用小鼠和人的BMSCs(bone marrow stem cells,骨髓干细胞)分化模型,利用链特异性建库技术对分化前后的细胞进行转录本超高深度测序,获得了600余G的原始数据,然后利用团队自主研发的FANSe3算法进行分析,极高的精度和容错性使得研究团队可以充分利用每一点原始数据,精准定量丰度极低的lncRNA。研究团队在人的BMSCs成骨分化过程中发现了2028个差异表达的lncRNA分子,而在小鼠的BMSCs成骨分化过程中发现了1436个差异表达的lncRNA分子。通过生物信息学分析,对这些差异表达的lncRNA基因在序列相似性、时序表达、基因组织等多方面进行了系统的评估,课题组鉴定到一个人和小鼠成骨细胞中都特异性上调的lncRNA分子(命名为lnc-Ob1/lnc-OB1)。进一步研究表明,在老年人成骨细胞中lnc-OB1的表达发生增龄性下调;去卵巢和老年小鼠成骨细胞中lnc-Ob1的表达也发生显著下调。如上结果提示lnc-Ob1很可能与骨形成有密切关系,并且在骨质疏松发生发展过程中有重要的调控作用。
为分析lnc-Ob1在体内的功能,研究团队构建了成骨细胞特异性lnc-Ob1敲入小鼠。通过系统的骨形态计量学和组织学分析,发现在体内lnc-Ob1能够明显促进骨形成并增加骨量。而成骨细胞靶向递送lnc-Ob1 的ASO抑制物,能够降低lnc-Ob1的表达使骨量减少。进一步体内实验显示,Inc-Ob1基因敲入小鼠体内的成骨细胞数目显著增加,长骨和椎骨处的松皮质和皮质骨的骨量都显著高于野生对照小鼠,具有很强地抵抗骨量丢失的能力。进而,研究团队利用前期构建的成骨细胞靶向递送系统【3】,实现了骨质疏松小鼠的Inc-Ob1靶向基因治疗。结果表明,治疗后的小鼠骨形成能力显著增强,骨量显著增加。值得注意的是,与PTH等常规骨质疏松治疗药物相比,lnc-Ob1基因治疗实现了与常规药物类似的治疗效果。
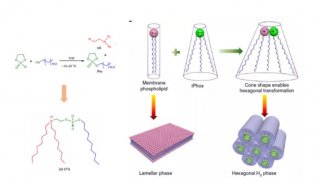
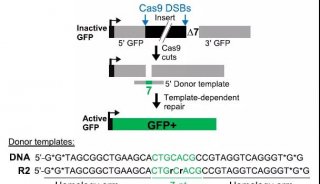
进一步机制研究发现:Inc-Ob1通过抑制Osterix (关键的成骨调节转录因子)启动子的H3K27me3甲基化,显著上调Osterix在小鼠和人成骨细胞中的表达,从而促进成骨细胞成熟分化。在成骨细胞的细胞核内,Inc-Ob1能够与Suz12结合,削弱了H3K27甲基化酶复合体在Osterix启动子上的募集程度(下图),从而增强Osterix的表达,促进成骨细胞分化和骨形成。

lnc -Ob1调控Osterix表达的机制示意图
目前应用于的临床唯一高效促进骨形成药物-甲状旁腺激素PTH,存在着两年使用时限、骨折治疗不敏感、潜在骨肉瘤风险等弊端。所以,骨形成药物的开发“瓶颈”急需新的策略和机制来解决。该研究发现了一个成骨细胞特异性表达的长非编码RNA(lnc-Ob1)能够有效促进骨形成,实现成骨细胞靶向递送Inc-Ob1可以有效抵抗卵巢切除引起的小鼠骨质疏松。这些发现揭示了lncRNA在骨形成中的重要作用,提示骨组织特异性IncRNA可能作为一种潜在的骨质疏松疾病治疗新策略。
北京航空航天大学的王晓刚研究员、同济大学口腔医学院王佐林教授、孙瑶教授和暨南大学的张弓教授是本论文的共同通讯作者。孙瑶、蔡明详、钟嘉泳为本文的共同第一作者。据悉,近年来王晓刚和孙瑶教授课题组合作,在非编码RNA调节硬组织发育及矿化领域发表了一系列原创性研究工作,重点关注硬组织疾病相关的非编码RNA治疗靶点及靶向治疗技术研发。前期系列成果发表于Nature Medicine,Nature Communication,ACS Nano, Journal of Bone and Mineral Research,Journal of Dental Research等杂志。
参考文献
[1]Yang L, Froberg J E, Lee J T. Long noncoding RNAs: fresh perspectives into the RNA world [J]. Trends in Biochemical Sciences, 2014, 39(1): 35-43.
[2] Zhuang, W.Z. et al. Upregulation of lncRNA MEG3 promotes osteogenic differentiation of mesenchymal stem cells from multiple myeloma patients by targeting BMP4 transcription. Stem Cells 33, 1985-1997 (2015).
[3] Sun, Y. et al. Osteoblast-targeting-peptide modified nanoparticle for siRNA/microRNA delivery. ACS Nano 10, 5759-5768 (2016).
-
科技前沿

-
焦点事件
-
科技前沿

-
焦点事件

-
科技前沿
-
科技前沿

-
焦点事件

-
科技前沿

-
科技前沿

-
焦点事件
-
焦点事件

-
科技前沿

-
焦点事件