Mol Neurodegener | 彭隽敏/柏兵重磅综述:基于质谱的蛋白质组学在阿尔兹海默症中的应用
景杰学术 | 报道
阿尔兹海默症(AD)是一种与衰老相关的神经退行性疾病,生化和遗传证据的整合证实了AD的直观分子机制,引入了多种假说与模型。然而,介导Aβ和tau蛋白毒性的共识分子途径、细胞回路和病理生理机制尚未完全清楚。蛋白质组学技术的高速发展与应用,为精准了解AD患者大脑蛋白质网络的复杂变化,找到有效的预防、治疗药物提供了诸多裨益。

图、蛋白质组学与AD研究中的主要历史事件
近日,美国田纳西州圣裘德儿童研究医院彭隽敏教授、柏兵教授(本文的共同通信作者,现为南京大学医学院附属鼓楼医院副研究员)等在Molecular Neurodegeneration(IF=14.195)杂志发表了题为“Proteomic landscape of Alzheimer’s Disease: novel insights into pathogenesis and biomarker discovery”的综述文章,介绍了蛋白质组学、蛋白质修饰组学技术在AD发病机理与标志物鉴定中的最新进展及重要价值。

1、基于质谱的蛋白质组学在AD中的技术应用
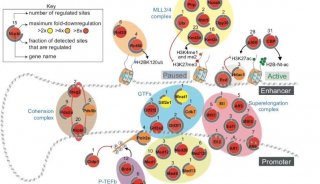
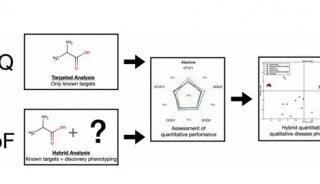
基于质谱的蛋白质组学分析,通常由三个主要步骤组成: (i)质谱前样品处理,(ii)质谱数据采集,(iii)质谱后生物信息学,以实现对蛋白质进行鉴定和定量的目标(下图)。因为关键的调节蛋白通常在细胞中丰度较低,不能通过浅层蛋白质组学分析检测到,所以定量深度,即可鉴定的蛋白质数量,是评估发现蛋白质组学(Discovery Proteomics)技术不可或缺的度量。

图、蛋白质样品的质谱分析
2、对AD蛋白质组的无偏分析
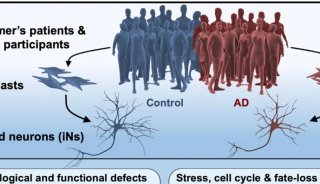
表征大脑的整体蛋白质组学变化是近年来AD研究的焦点之一。彭隽敏教授、柏兵教授团队对五组近200例人脑皮层组织进行了全景式蛋白组学及磷酸化修饰组分析[1],总共鉴定到14,513个蛋白和34,173个磷酸化位点,达到了AD蛋白组学研究领域中前所未有的覆盖率和深度。研究鉴定到173个差异表达(DE)蛋白,分布于17条信号通路上,其中80%左右的蛋白是新发现蛋白,为疾病机制的揭示提供全新的线索。而在综述中,作者进一步对来自于3个独立研究团队的7个深度蛋白质组数据集进行整合分析,汇总共得到12017个蛋白质,同时揭示了不同细胞类型对AD发病机制的贡献(下图)。

图、整合7个深度AD数据集的Meta分析,鉴定出12017个蛋白质
3 、蛋白质组学图谱揭示AD进展机制
蛋白组图谱分析进一步揭示AD发展进程。如下图平衡模型所示,从轻度认知障碍(MCI)到AD的转变可能是由有害事件上调和保护事件减少引起的,这一变化过程与tau蛋白的病理性显著增加趋势一致。更重要的是,AD相关蛋白的功能在疾病的长期发展过程中很可能是多因素的,它们是否发挥保护或有害的作用取决于时间、区域和细胞环境。

图、AD疾病进展过程中有害和保护因素的平衡模型
4、AD中蛋白质组的翻译后修饰
蛋白质的功能除表达丰度外,还受到翻译后修饰(PTM)和动态蛋白相互作用的严格调控。例如,Tau蛋白聚集与广泛的PTMs相关,包括磷酸化、泛素化、乙酰化、甲基化、糖基化、类泛素化等。Tau蛋白的泛素化可能有助于纤维多样性[2];在AD中发现了过度磷酸化的tau蛋白和骨桥蛋白(SPP1)以及特异性的多泛素化链(Lys11、Lys48和Lys63)[3]。精确定量分析AD过程中PTMs,对于研究AD发病过程中的生化信号通路具有重要价值。
5 基于蛋白质组学的AD生物标志物的发现
基于质谱的脑脊液(CSF)蛋白质组学,在发现生物标志物方面取得了令人振奋的进展[1,4]。对于脑脊液、血液等富含高丰度蛋白的样本,高丰度蛋白会掩盖低丰度蛋白,影响对于低丰度蛋白质的鉴定。因此去除高丰度蛋白是提高其蛋白质组学鉴定深度的一种常用策略。通过对6个深度脑脊液数据集的Meta分析,研究总共得到5939个蛋白,其中包括311个上调蛋白和165个下调蛋白,为未来的验证提供了AD脑脊液蛋白质组的资源(图6)。

图、一个整合了6个深度脑脊液数据集的Meta分析
值得一提的是,整合脑脊液蛋白组和脑蛋白质组数据,将有助于特异性脑脊液生物标志物的选择。基于AD的血浆/血清样本、细胞外囊泡(EV)[5]等均可以用来进行更全面的分析,以用来探索新的AD生物标志物。
总之,蛋白质组学的发展为AD疾病机制及生物标志物的鉴定提供了有力武器,我们有望发现更多的分子改变和特征蛋白质,从而进一步揭示AD发病机制和潜在的生物标志物。蛋白质组学驱动的系统生物学为连接基因型、蛋白质型和表型提供了一个新的前沿,加速了改进的AD模型和治疗策略的发展。
2020开门红!Neuron:彭隽敏团队蛋白质组学研究为阿尔茨海默病发病机制和临床诊断提供新线索

Nature Medicine重磅突破,报道迄今为止最大规模的阿尔兹海默症蛋白组学研究

新热点!连发Nat Genet & Nat Neurosci,PWAS揭示阿尔茨海默症全新机制

阿尔兹海默症专题系列2 | 还需多少昼夜,才能认清你的千姿百态

Sci Adv | 揭示迄今阿尔兹海默症最完整的糖基化修饰分子网络全景以及AD调控机制

最一致的AD信号,超深度蛋白质组证实线粒体蛋白可作为阿尔茨海默症的新标志物

参考文献1 Bai, B. et al., 2020, Deep Multilayer Brain Proteomics Identifies Molecular Networks in Alzheimer''s Disease Progression. Neuron.2 Arakhamia, T. et al., 2020, Posttranslational Modifications Mediate the Structural Diversity of Tauopathy Strains. Cell.3 Dammer, E. B. et al., 2011, Polyubiquitin linkage profiles in three models of proteolytic stress suggest the etiology of Alzheimer disease. J Biol Chem.4 Wang, H. et al., 2020, Integrated analysis of ultra-deep proteomes in cortex, cerebrospinal fluid and serum reveals a mitochondrial signature in Alzheimer''s disease. Mol Neurodegener.5 Cocozza, F., et al., 2020, SnapShot: Extracellular Vesicles. Cell.6 Bai, B. et al., 2021, Proteomic landscape of Alzheimer''s Disease: novel insights into pathogenesis and biomarker discovery. Mol Neurodegener.本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。
 #关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)
#关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)
-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章








