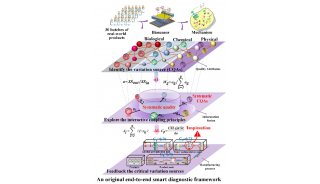
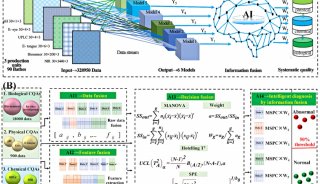
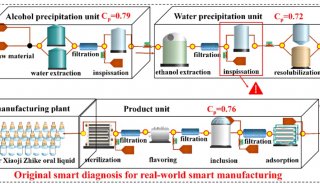
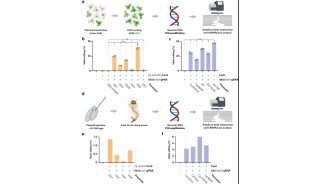
Cell发布CRISPR/Cas9重要研究成果
来自东京大学、麻省理工学院与哈佛大学Broad研究所的研究人员,在新研究中揭示出了新凶手弗朗西丝菌Cas9(FnCas9)的结构,并利用这一结构信息对FnCas9进行改造构建出了一个变异体。研究成果发布在2月25日的《细胞》(Cell)杂志上。
京东大学医学科学研究所基础医学系Osamu Nureki教授,及Nureki实验室生物物理学和生物化学助理教授Hiroshi Nishimasu是这篇论文的共同通讯作者。Broad研究所核心成员张锋(Feng Zhang)博士是这篇论文的合著作者。2014年2月,张锋曾与Nureki教授联手合作生成了CRISPR/Cas系统关键组成部分——Cas9复合体的第一张高分辨率图像。这一重要的研究成果发布在Cell杂志上。
来自CRISPR -Cas系统的RNA引导DNA核酸内切酶Cas9,可以结合双RNA导向序列crRNA (CRISPR RNA)和tracrRNA(trans-activating RNA),或合成的单导向RNA(sgRNA),切割与导向RNA互补的双链靶DNA。当前有几种Cas9直系同源物,例如化脓性链球菌Cas9 (SpCas9)和金黄色葡萄球菌Cas9 (SaCas9)已被利用于真核生物细胞中实现基因组编辑。科学家们还在致力不断地改进这些技术。
在发表于2015年11月Nature Biotechnology杂志上的一篇研究论文中,研究小组报告称演化出了SaCas9的一种变体,它能够识别更广泛的核苷酸序列,靶向以往CRISPR-Cas9技术无法触及的基因组位点。
2015年12月,张锋领导麻省理工学院-哈佛医学院Broad研究所和麻省理工学院McGovern脑研究所的研究人员,设计改造了革命性的 CRISPR-Cas9基因编辑系统,大大减少了“脱靶”编辑错误。这一完善的技术解决了使用基因组编辑时面对的一个主要技术问题。研究论文发表在 Science杂志上。
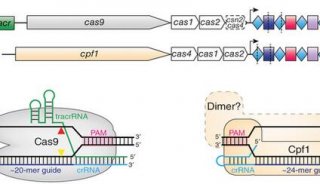
除了要求RNA-DNA互补配对,Cas9识别和切割DNA还需要在靶DNA序列的邻近下游存在“PAM” ( protospacer adjacent motif)的短DNA序列,由此限制了Cas9介导基因组编辑可靶向序列的范围。来自不同微生物的Cas9直系同源物识别不同的PAM序列,SpCas9和SaCas9分别识别5′-NGG-3′和5′-NNGRRT-3′ PAMs。
Cas9直系同源物的长度和序列具有高度的差异,氨基酸残基的数量在大约900-1600之间,FnCas9是最大的成员之一。FnCas9包含 1,629个氨基酸,相比于其他的Cas9直系同源物如SpCas9 (1,368个氨基酸)和SaCas9 (1,053个氨基酸)要大得多。值得注意地是,以往的一项研究报道FnCas9不仅可以介导crRNA:tracrRNA依赖性DNA切割,还可介导 scaRNA(小CRISPR/Cas相关RNA):tracrRNA依赖的基因表达调控。但目前对于FnCas9执行其双重功能的机制仍不清楚。此外,也尚未探索FnCas9在基因组编辑应用中的潜力。
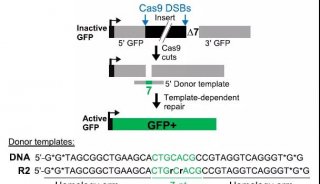
在这篇Cell新文章中研究人员报告称,获得了FnCas9–sgRNA–靶DNA复合物的晶体结构,分辨率达到1.7 埃(Å)。通过比较FnCas9和其他Cas9直系同源物SpCas9 与SaCas9,揭示出了亲缘关系遥远的CRISPR-Cas9系统之间的保守特征及惊人的结构差异。他们发现FnCas9识别的是5′-NGG-3′ PAM,并利用这一结构信息构建出了一个识别5′-YG-3′ PAM的Cas9异构体。此外,研究人员证实可以将预组装的FnCas9–sgRNA核糖核蛋白(RNP)复合物通过显微注射到小鼠受精卵中编辑具有5′ -YG-3′ PAM的内源性位点,由此扩大了CRISPR-Cas9工具箱的靶向空间。
-
招标采购

-
企业风采

-
项目成果

-
精英视角

-
焦点事件

-
项目成果

-
项目成果

-
企业风采

-
焦点事件

-
科技前沿

-
焦点事件

-
会议会展

-
科技前沿
-
焦点事件

-
科技前沿

-
焦点事件

-
科技前沿

-
焦点事件

-
精英视角

-
焦点事件

-
焦点事件

-
科技前沿

-
科技前沿
-
技术原理
-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
科技前沿

-
项目成果
-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
精英视角

-
精英视角

-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角

-
精英视角

-
精英视角

-
项目成果

-
焦点事件

-
焦点事件
-
项目成果
-
焦点事件

-
项目成果
-
焦点事件

-
精英视角

-
科技前沿

-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件