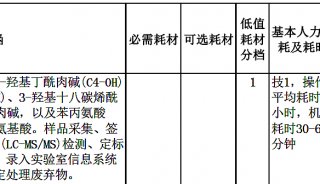
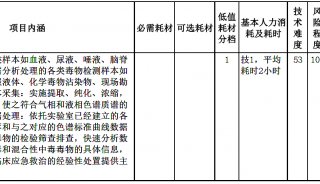
明胶酶谱法操作
实验概要
酶谱法的基本过程是先将样品进行SDS-聚丙烯酰胺(SDS-PAGE,含0.1%明胶)电泳分离,然后在有二价金属离子存在的缓冲系统中使样品中的MMP-2和MMP-9恢复活性,在各自的迁移位置水解凝胶里的明胶,最后用考马斯亮蓝将凝胶染色,再脱色,在蓝色背景下可出现白色条带,条带的强弱与MMP-2和MMP-9活性成正比。
复性原理:在电泳过程中,SDS与样品中的MMPs结合(当然是可逆性结合),破坏其氢键、疏水键而使MMPs不能发挥其分解明胶的作用,而只有当将胶置Trition中洗脱(最好是放在摇床上摇,30min/次,做2次或15min/次,4次。静置于Trition中是不妥的。)时,由于SDS被Trition结合而去除,从而使MMPs恢复了活性。
主要试剂
分离胶
浓缩胶
5×Tris –甘氨酸电极缓冲液
4 ×上样缓冲液
洗脱液
漂洗液
孵育液
染色液
脱色液A、B、C
实验步骤
1. 取对数期的癌细胞在的无血清培养基DMEM中培养24h。
2. 次日收集上清液,将上清液移入离心管中 2000rpm 离心10min,-70℃储存备用。
3. 根据细胞计数调整各组细胞培养上清液中的蛋白浓度(或者测定蛋白浓度调整使所上蛋白总量一致)。与5×上样缓冲液混合,13ul样本 4ul上样缓冲液。(不要用枪用力吹打,防止出现过多气泡)
4. 配制分离胶和浓缩胶,16ul/孔上样(根据表达强度和蛋白浓度确定上样量),4℃进行SDS-PAGE 电泳100v约1.5小时(电泳时在周围敷上冰,有利于使条带跑直)。
5. 电泳结束后,将凝胶置于洗脱液(2.5% Triton X-100,50mmol/L Tris -HCl ,5mmol/L CaCl2,pH7. 6) 中振荡洗脱2次,每次40分钟,然后用漂洗液(除不含Triton X - 100 外其余同洗脱液) 漂洗2次,每次20分钟,接着,将凝胶置于孵育液( 50mmol/L Tris - HCl , 5mmol/ CaCl2 , 0. 02% Brij-35 ,pH7.6) 中37℃ 孵育42h。
6. 孵育结束后经染色液(0.05% Coomassic 亮蓝、30%甲醇、10%乙酸) 染色3h,及脱色液A、B、C(甲醇浓度分别为30%、20%、10 % ,乙酸浓度分别为10 %、10 %、5%) 分别脱色0.5、1、2h后,显示出MMP-2(72KD) 和MMP -9(92 KD)为位于蓝色背景上的透亮带,用凝胶图像分析系统分析读取条带面积,宽度和灰度值,做统计分析。
注意事项
1. 制备聚丙烯酰胺时应注意排除气泡 。
2. 明胶酶谱的活性受钙离子,锌离子,和PH值等因素的影响,因此缓冲液 配制应严格准确,尽量用超纯水,孵育温度也掌握好。
3. 用大梳子。
4. 孵育液的PH最好在7.5-7.6,复性的TRITON时间长了会有絮状物,所以实验时尽量使用新鲜配置的。
5. 孵育的37度不要在CO2培养箱中,因为会改变孵育液的PH值,在普通孵箱即可。
6. 明胶要4度保存,配好后1周内使用。
-
产品技术

-
企业风采

-
招标采购

-
焦点事件

-
标准

-
企业风采

-
焦点事件

-
综述

-
投融资

-
会议会展

-
企业风采

-
会议会展

-
会议会展

-
焦点事件
-
企业风采

-
企业风采

-
精英视角

-
精英视角

-
精英视角

-
焦点事件

-
焦点事件

-
精英视角

-
精英视角

-
企业风采

-
企业风采

-
企业风采

-
企业风采

-
企业风采

-
精英视角

-
会议会展

-
企业风采

-
产品技术
-
产品技术

-
企业风采

-
企业风采

-
企业风采

-
项目成果
-
企业风采

-
焦点事件

-
企业风采

-
企业风采

-
精英视角

-
企业风采

-
会议会展

-
精英视角

-
产品技术

-
精英视角

-
产品技术

-
精英视角

-
会议会展

-
焦点事件

-
会议会展

-
焦点事件

-
投融资

-
焦点事件
-
焦点事件

-
企业风采

-
焦点事件
-
会议会展

-
综述
-
精英视角