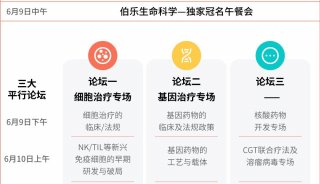
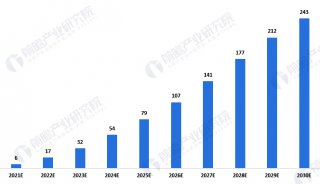
58.3%的晚期非小细胞肺癌患者生存期超2年!
肺癌是全球发病率最高及死亡率最高的恶性肿瘤,发病率和死亡率分别占全部肿瘤的11.6%和18.4%。其中非小细胞肺癌(NSCLC)患者约占85%,晚期患者既往5年生存率约为5%。
铂类化学疗法一直是晚期非小细胞肺癌的标准一线治疗方案。但是,化学疗法的毒性和副作用会影响患者的身体健康和生活质量,而且治疗效果有限,在过去十年内没有很大的发展。尽管非小细胞肺癌的治疗随着相应突变患者靶向药物的发展而有所改善,但只有一小部分肿瘤存在这些突变,大多数肿瘤对靶向治疗会产生耐药性。
近两年,免疫检查点抑制剂无疑是最成功的肿瘤免疫疗法之一,已经改变了肺癌的治疗前景。在化疗时代,晚期肺癌患者五年生存率极低,仅5%左右。而已有数据显示,部分类型的肺癌患者采用免疫治疗,其五年生存率可高达31.9%,足足提高了6倍!这无疑给更多的患者带来了“免死金牌”。
但不尽人意的是,PD-1仅对20%~30%的患者起效,并且产生的中度至严重副作用高达30%,如何让更多的患者能够获益于免疫治疗,如何进一步提升免疫治疗的有效率是肿瘤学家们现在和未来积极探索的方向。
近两年来,除了CAR-T疗法备受万众瞩目外,基于自然杀伤(NK)细胞的免疫疗法已成为治疗实体瘤和血液系统恶性肿瘤的一种有前途的治疗方法。研究人员说,NK细胞作为一种细胞抗癌疗法更具潜力,它可能会更安全、更便宜、更快速。
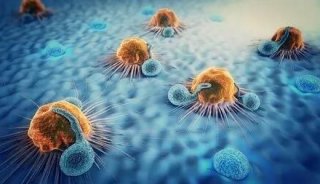
人体内冲锋陷阵斗士——NK细胞
NK细胞是人体第三类淋巴细胞,又被誉为天然免疫的核心细胞,约占淋巴细胞循环数的5%~15%,是对抗癌细胞的天生战士。其表面缺少T细胞和B细胞的特异性标志如TCR和Smlg,曾称为裸细胞。
与其他抗癌免疫细胞相比,如细胞毒性T细胞或树突状细胞,NK细胞杀灭肿瘤和病毒感染细胞的作用更强、更有效。它的激活不需要抗原递呈过程,不用别人通风报信,就可以直接、快速将外来异物(病毒、细菌、感染细胞、癌细胞、衰老细胞等)就地正法。NK细胞游弋在全身血管行使免疫监视功能,它能在第一时间发现并启动免疫防御功能,迅速杀死病变、癌变的细胞,因此被医学界公认为抗癌第一道防线。
如果将人体当成一场“战疫”的缩影,那么当面对病毒或癌细胞攻击时,我们的社会也会启动“免疫反应”,成千上万的医务工作者奔赴疫情严重地区。若要用人体的一种免疫细胞来形容医务工作者的话,很容易会联想到人体内先天性免疫系统的自然杀伤细胞(NK)细胞。

自然杀伤细胞(黄色)攻击癌细胞(来源:科学之眼)
针对一线治疗失败的非小细胞肺癌,NK联合PD-1生存期翻倍!
在2022年世界肺癌大会上,NKGen Biotech公司宣布,自体NK细胞疗法SNK01,与PD-1抑制剂帕博利珠单抗(pembrolizumab)联用,治疗非小细胞肺癌的长达2年的随访数据。
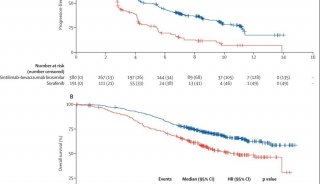
试验结果显示,与帕博利珠单抗单药相比,组合疗法治疗的患者无进展生存期(PFS)显著延长。

NKGen的创新NK细胞免疫疗法使用从患者血液中提取的高纯度NK细胞,扩增并激活后回输患者体内。目的是改善免疫系统功能,消除受感染或异常细胞,防止疾病复发(图源NKGen公司官网)
此次入组的20例晚期非小细胞肺癌患者均在既往一线铂类药物治疗中失败。其中6名患者接受帕博利珠单抗单药治疗,14名患者接受不同剂量SNK01联合治疗(2x10^9个细胞或4x10^9个细胞)。
试验数据表明,SNK01联合治疗组患者的中位无进展生存期(PFS)为6.2个月,明显优于帕博利珠单抗组的1.7个月;此结果证明组合疗法增强了患者临床治疗的抗肿瘤活性。
此外,2年的长期随访结果显示,联合治疗组生存率为58.3%,PD-1单药组为16.7%,联合治疗组的生存率增长了41.6%。
关于客观缓解率,之前在2020年ASCO大会上曾报道过,联合治疗组的总体缓解率(ORR)为44%,与Keytruda单独治疗的0%相比,明显更高;并且接受最高剂量的NK细胞治疗的患者的ORR可以达到50%。
现货型NK细胞疗法突出重围,完成首例非小细胞肺癌患者给药!
近期,专注于开发新型NK细胞疗法的国外肿瘤免疫治疗公司和希望之城宣布,其开发的现货型NK细胞治疗候选管线CYTO-102已完成1期临床试验的首例患者给药,主要是用于治疗非小细胞肺癌!
CYTO-102是一种由PD-L1阳性肿瘤反应性NK细胞(TRACK-NK) 组成的通用型细胞疗法,通过对NK细胞进行基因修饰以分泌高水平的可溶性IL-15。
此次临床试验旨在评估CYTO-102单药或与atezolizumab(阿特珠单抗)联用治疗复发/难治性NSCLC患者的安全性和耐受性,以及关键的生物学终点包括NK细胞持久性和转运,肿瘤微环境的变化以及被CYTO-102募集的内源性T细胞和NK细胞。

CytoImmune研发管线
CYTO-102设计为一种通用型细胞疗法,可以直接杀死癌细胞,也广泛刺激人体自身的内源性免疫系统,并通过产生高效的免疫反应来增强肿瘤杀伤力,最终改善患者的疗效。
非小细胞肺癌治疗虽然取得了进展取得了进展,但仍然是一种难以治疗的癌症,太多患者没有持久有效的治疗选择。此种新型细胞疗法有望成为非小细胞肺癌患者的一个新的治疗选择,让我们拭目以待其疗效!
NK细胞疗法治疗EGFR突变阳性的肺腺癌,效果更佳
一项于2019年12月发表于《Precision Clinical Medicine》杂志的研究,主要探讨自然杀伤(NK)细胞免疫疗法对有或无EGFR突变的非小细胞肺癌的有效性,以评估缓解率(RR)和无进展生存期(PFS)。

NK细胞治疗组的血清CEA和CA125值低于非NK治疗组(P<0.05)。结果表明,NK细胞治疗组的缓解率(RR)为75%,明显高于非NK治疗组的16.7%(P
通过评估免疫功能、肿瘤生物标志物、CTC、KPS和PFS的变化,此研究证明NK细胞治疗对EGFR突变阳性的肺腺癌具有更好的临床治疗效果。
给NK细胞装上“弹头”,CAR-NK杀伤力倍增
目前用于肿瘤免疫治疗的NK细胞策略有:体外活化的自体或异体NK细胞治疗;联合NK细胞和单抗药(如免疫检查点抑制剂)来诱导抗体特异的细胞毒性;构建CAR-NK细胞免疫疗法。而CAR-T细胞疗法取得的成功激发了人们对用CAR基因修饰NK细胞来增强其杀肿瘤能力的热情。
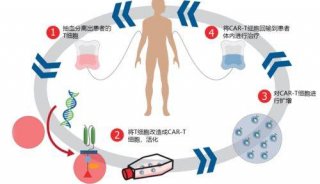
CAR-NK就是利用基因工程给NK细胞加入一个能识别肿瘤细胞,并且同时激活NK细胞杀死肿瘤细胞的嵌合抗体。嵌合抗原受体能显著提高NK细胞疗效特异性。这个思路和CAR-T的构建类似:CAR包括胞外的识别结构域(如scFv)识别肿瘤特异性抗原;一个跨膜结构域,和一个胞内信号结构域(CD3ζ 链)可以诱导NK细胞的活化。

图为构建CAR-NK细胞免疫疗法的过程
CAR-NK细胞比CAR-T细胞具有多个优势
1
与CAR-T细胞不同,CAR-NK细胞保留了通过其天然受体识别和靶向肿瘤细胞的内在能力,从而通过CAR-NK靶向治疗时,肿瘤细胞能够逃脱杀伤的可能性降低。
2
CAR-NK细胞在数天至数周内不会发生免疫排斥反应。因此,它们在许多CAR-T临床试验中均未表现出相同的安全问题,例如没有细胞因子释放综合征的困扰。
3
NK细胞不需要严格的HLA匹配,并且没有引起移植物抗宿主病的潜力,这却是CAR-T细胞免疫疗法一种重要的风险。
初露锋芒!晚期非小细胞肺癌患者采用改良CAR-NK治疗后,肿瘤显著缩小!
一项于2022年5月3日发表于《Cell Transplantation》上的研究中,报道了采用改良后的CAR-NK疗法治疗晚期非小细胞肺癌患者的病例分析。
国内研究者们首先在体外验证了CCCR-NK92细胞对肺癌细胞系的杀伤作用,最后,在人肺癌NOG小鼠皮下异种移植模型中进行了动物实验,用 CCCR-NK92 细胞处理的小鼠的肿瘤体积明显小于对照组,在实验小鼠中未观察到明显的毒副作用。
此后,他们设计了一项II期临床试验来评估CCCR-NK92 细胞疗法的疗效和安全性。
2017年2月2日,69岁的女性患者被确诊为非小细胞肺癌,影像结果显示颅内转移,而基因检测显示 Exon-19 19-del 突变和 T790 突变,以及肺组织中 PD-L1 表达≥1%。她第一次服用吉非替尼 3 个月。然而,由于疾病进展,她改用奥希替尼 10 个月。之后,她因颅内转移于 2018 年 7 月 13 日接受了头部放疗。3个月后给予靶向治疗药物和局部放疗,然后于2018年9月27日进行评估。她因害怕副作用拒绝化疗。考虑到她的条件合适,她参加了包含用于 NSCLC 的 CCCR-NK92 细胞的临床试验。
经3周期的治疗后,CT图像显示细胞疗法在治疗肿瘤方面具有一定的疗效。具体来说,左肺包裹的胸腔内液体从46.22mm减少到 33.59mm(图 2A ~2C),而前气管-后腔静脉间质区域的淋巴结从11.3mm减少到8.55mm(图2B~2D)。

NK细胞治疗前景广阔,未来可期!
CAR-NK细胞疗法是一个很有前途的临床研究领域,对某些癌症患者具有良好的安全性和初步疗效。与CAR-T细胞相比,CAR-NK细胞具有自己独特的优点,但仍面临着一些挑战。这些挑战包括细胞增殖的改善,使细胞毒性的激活更有效,以及最终找到NK细胞的最佳重建方法。相信解决好这些问题,基于NK细胞优秀的抗肿瘤血统,极有可能在CAR修饰的武装下为肿瘤治疗带来新的突破。
鉴于CAR-T的成功、CAR-NK的快速发展,将CAR工程技术沿袭用于其他类型免疫细胞的工程化改造引起了研究者们极大的兴趣。
-
焦点事件

-
焦点事件

-
政策法规

-
焦点事件

-
科技前沿

-
焦点事件

-
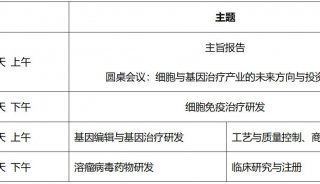
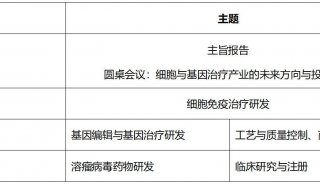
会议会展

-
科技前沿

-
焦点事件

-
焦点事件

-
项目成果

-
会议会展

-
项目成果
-
会议会展

-
科技前沿

-
企业风采

-
焦点事件

-
产品技术

-
会议会展

-
企业风采

-
科技前沿

-
科技前沿
-
科技前沿
-
科技前沿
-
项目成果

-
会议会展

-
焦点事件

-
会议会展

-
焦点事件

-
市场商机

-
技术原理
-
技术原理
-
技术原理
-
技术原理

-
综述
-
精英视角

-
科技前沿

-
项目成果

-
技术原理

-
技术原理
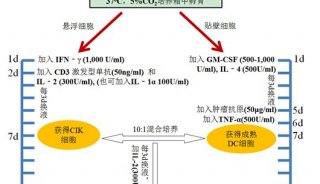
-
技术原理
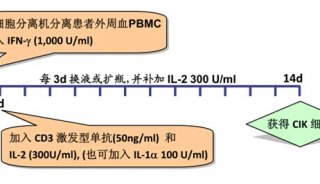
-
技术原理

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
项目成果

-
焦点事件
-
焦点事件

-
焦点事件
-
焦点事件

-
项目成果
-
焦点事件

-
科技前沿
-
焦点事件

-
科技前沿

-
科技前沿

-
焦点事件

-
科技前沿
-
焦点事件

-
技术原理
-
科技前沿
-
精英视角

-
项目成果
-
科技前沿

-
精英视角

-
焦点事件
-
焦点事件