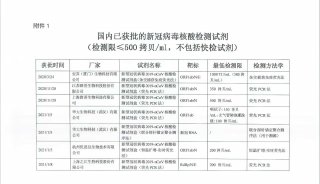
百人博士最新Nature子刊文章:泛素化修饰的特殊因子
细胞内蛋白泛素化经由泛素-蛋白酶体途径实现。在这个过程中,一系列酶(E1、E2和E3)调控泛素链组合体,而且当正确的泛素化发生之后,一个冗余的或受损的蛋白就会被蛋白酶体破坏掉,关于泛素链形成的机制尚不是十分清楚。
来自中国科学院动物研究所,美国国立卫生研究院的研究人员近期发现在蛋白质泛素化修饰过程中还存在一个额外的泛素链延伸因子,他们揭示了第一个被被鉴定出来的E4:Ufd2p延长泛素链的作用机制,这将大大的拓展了人们对蛋白质泛素化修饰领域的认识。
这一研究成果公布在2月7日的Nature Communications杂志上,文章的通讯作者是动物研究所李卫研究员,助理研究员刘超博士为第一作者。李卫研究组主要从事蛋白质泛素化和类泛素化修饰的分子机制及其在配子发生中的作用机制方面的研究,从配子成熟、减数分裂、体细胞-生殖细胞互作和干细胞维持与分化四方面系统深入地解析泛素化和类泛素化修饰在配子发生和干细胞维持过程中的调控机理。
蛋白质泛素化修饰需要泛素经过泛素激活酶(E1)、泛素接合酶(E2)以及泛素连接酶(E3)的逐步催化转移到底物蛋白上。在这篇文章中,研究人员通过在体外重构Ufd4p-Ufd2p泛素催化体系,发现Ufd2p可以在Ufd4p合成的Lys29连接泛素链上催化Lys48连接的多位点单泛素化修饰进而形成树枝状泛素链。在离体和在体条件下,均可以在泛素融合蛋白Ub-V-GFP上检测到这种树枝状泛素链。
Ufd2p催化此类反应需要其氨基端的两个环区识别Ub-V-GFP上的Lys29连接泛素链。Ufd2p催化合成的这种树枝状泛素链可以被蛋白酶体衔接蛋白,如Rad23p,Dsk2p以及Rpn10p等识别,进而介导其修饰底物蛋白的降解。因此,Ufd2p可以作为一种新型的泛素链转换因子,将非降解型泛素链信号转换为可被蛋白酶体识别的降解型泛素链信号,进而促进修饰底物的降解。Ufd2p这种泛素链连接形式转换的功能在内质网相关的蛋白质降解(ERAD)、OLE通路以及酸性条件耐受等方面可以发挥重要作用。
这项研究揭示了Ufd2p(E4)延长泛素链的作用机制,Ufd2p作为泛素链转换因子的功能大大的拓展了人们对蛋白质泛素化修饰领域的认识。
-
焦点事件

-
政策法规

-
焦点事件
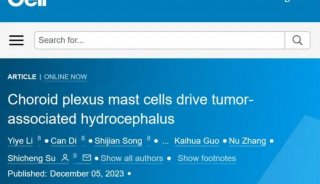
-
焦点事件

-
焦点事件

-
焦点事件

-
标准
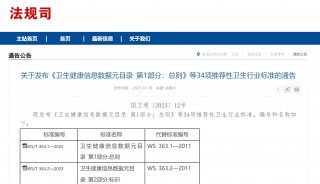
-
企业风采

-
精英视角

-
焦点事件

-
项目成果

-
政策法规

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
政策法规
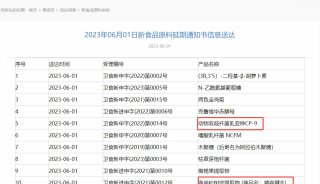
-
企业风采

-
企业风采

-
焦点事件

-
焦点事件

-
企业风采

-
企业风采

-
焦点事件

-
焦点事件
-
企业风采
-
精英视角

-
企业风采

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
精英视角

-
精英视角

-
焦点事件

-
政策法规

-
焦点事件

-
焦点事件

-
企业风采

-
企业风采

-
精英视角

-
焦点事件

-
焦点事件

-
焦点事件

-
人物动向

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
科技前沿

-
科技前沿
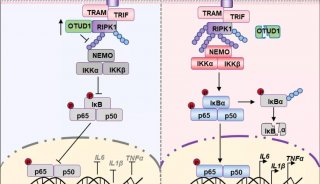
-
项目成果
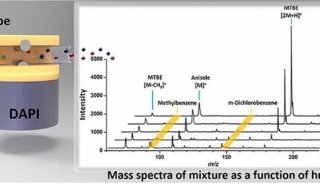
-
焦点事件

-
企业风采

-
精英视角

-
焦点事件

-
焦点事件

-
会议会展

-
企业风采

-
产品技术

-
企业风采

-
项目成果
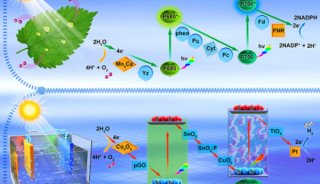
-
焦点事件

-
科技前沿

-
科技前沿

-
项目成果
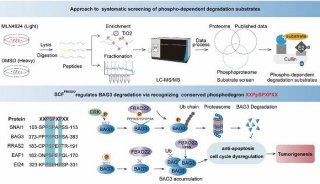
-
科技前沿
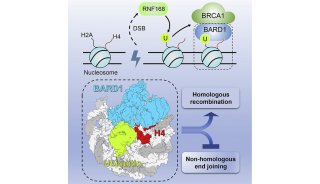
-
科技前沿

-
焦点事件
-
科技前沿

-
焦点事件

-
综述

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
综述

-
综述

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
综述

-
焦点事件

-
焦点事件
-
企业风采

-
企业风采

-
精英视角

-
项目成果
-
焦点事件

-
精英视角

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
实验室动态

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件
-
项目成果

-
企业风采

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
实验室动态

-
政策法规