泛素样蛋白的来源及功能
真核生物蛋白可以通过与各种小分子物质或蛋白质相结合的方式被修饰。在众多的修饰方式当中有一种就是与泛素蛋白或泛素样蛋白(UBL)相结合,采用这种抗原肽修饰方法可以对多种生理过程进行调控。UBL蛋白可以控制被修饰蛋白与其它生物大分子(比如蛋白酶体或染色质)间的相互作用。各种UBL系统都会使用相应的酶来催化修饰反应,不过这些修饰反应中大部分都是暂时的。有越来越多的证据表明这种UBL抗原肽修饰途径来自原核生物的硫转移酶系统(sulphurtransferase system)及相关酶类。而且,在真核生物的共同祖先中,类似于UBL连接酶和UBL去连接酶的蛋白也是广泛存在的,这些证据都说明UBL抗原肽修饰系统不是起源于真核生物。
真核细胞内的蛋白都会经历各种翻译后修饰,这些修饰过程极大地扩展了蛋白的功能多样性和动力学多样性。蛋白可以通过与磷酸基团、甲基化基团、乙酰基团或某些蛋白质基团(通常这种连接方式都是短暂的)相连接的方式被修饰。而泛素蛋白修饰方式就是上述与蛋白质相连的修饰方式中第一个被发现的。现在,我们已经对这种修饰途径研究得非常透彻了。泛素蛋白是一小分子蛋白,它在真核生物界非常保守,但是在真细菌界(Eubacteria)和古细菌界(Archaea)都不存在。泛素蛋白还可以与上千种不同的蛋白结合。
泛素化过程是一个复杂的过程(背景知识框1)。UBL修饰途径也与泛素化修饰途径类似。参与UBL修饰途径的酶虽然各不相同,但在进化上都与参与泛素化途径的酶具有相关性。由于泛素蛋白与UBL蛋白具有相同的三维核心结构——β-抓握折叠(β-grasp fold)结构——这说明各种不同的UBL修饰系统都源自一个共同的祖先。
-
产品技术

-
企业风采

-
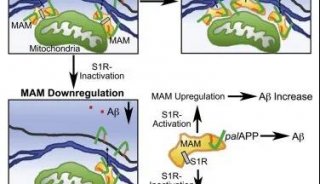
技术原理
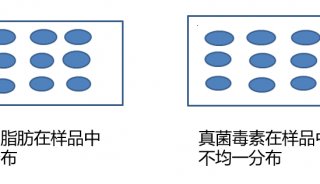
-
科技前沿

-
企业风采

-
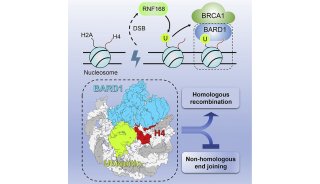
科技前沿
-
综述
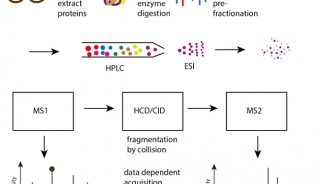
-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
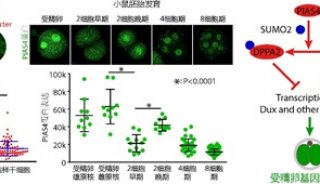
-
其它新闻