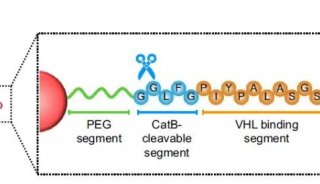
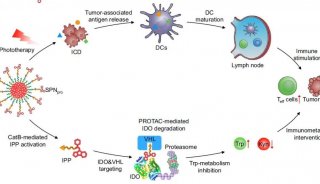
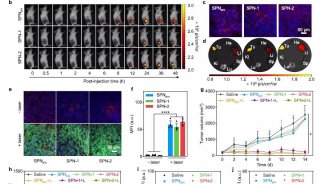
泛素的性质结构
基本信息
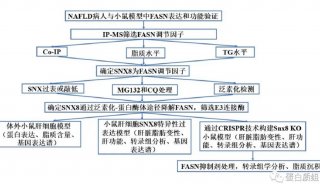
泛素(ubiquitin)是一类真核细胞内广泛存在的小分子蛋白质,大小为76个氨基酸残基。泛素间可以通过酶促反应相互连接,进而介导靶蛋白降解。
化学反应
催化的一系列反应的发生,整个过程被称为泛素化信号通路。在第一步反应中,泛素激活酶(又被称为E1)水解ATP并将一个泛素分子腺苷酸化。接着,泛素被转移到E1的活性中心的半胱氨酸残基上,并伴随着第二个泛素分子的腺苷酸化。被腺苷酸化的泛素分子接着被转移到第二个酶,泛素结合酶(E2)的半胱氨酸残基上。最后,高度保守的泛素连接酶(E3)家族中的一员(根据底物蛋白质的不同而不同)识别特定的需要被泛素化的靶蛋白,并催化泛素分子从E2上转移到靶蛋白上。通常认为,靶蛋白在被26S蛋白酶体识别之前,必须被标记上至少四个泛素单体形成的K48位或者K11位连接的多聚泛素链,但最新也有研究表明两个泛素单体形成的泛素链更能有效地被蛋白酶体降解。一般而言,是E3使得这一系统具有了底物特异性,而E2或者E2-E3决定底物上泛素链的类型。E1、E2和E3蛋白的数量依赖于生物体和细胞类型,人体中就存在大量不同的E3蛋白,这说明泛素-蛋白酶体系统可以作用于数量巨大的靶蛋白。
多泛素化后的蛋白质是如何被蛋白酶体所识别的,还没有完全弄清。泛素受体蛋白的N末端具有一个类泛素结构域,以及一至多个泛素结合结构域。类泛素结构域可以被19S调节颗粒所识别,而泛素结合结构域可以通过形成三螺旋束来结合泛素。这些受体蛋白可能能够结合多泛素化的蛋白质并将其携带到蛋白酶体,而关于这种结合的特异性和调控机制还不清楚。最终,被标记的蛋白质被蛋白酶分解为较小的多肽、氨基酸以及可以重复使用的泛素。
2004年,阿龙·切哈诺沃、阿夫拉姆·赫什科、欧文·罗斯因发现了泛素调解的蛋白质降解过程而获得了诺贝尔化学奖。
-
项目成果
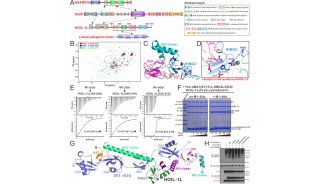
-
科技前沿

-
项目成果

-
企业风采
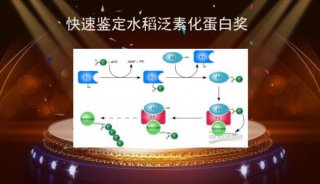
-
焦点事件
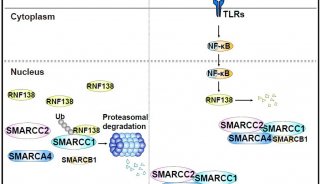
-
项目成果

-
科技前沿

-
焦点事件

-
综述
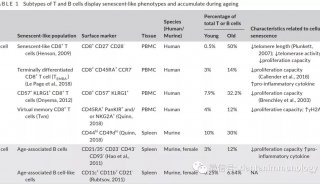
-
科技前沿
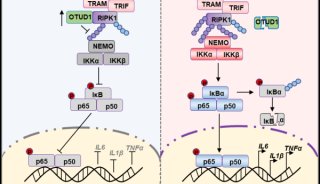
-
科技前沿

-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿

-
科技前沿

-
项目成果

-
项目成果
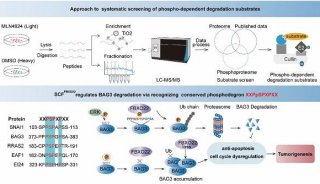
-
科技前沿

-
科技前沿
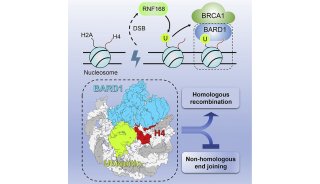
-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
技术原理
-
项目成果
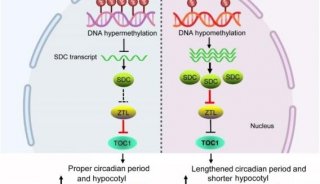
-
焦点事件

-
项目成果
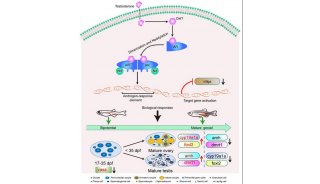
-
项目成果
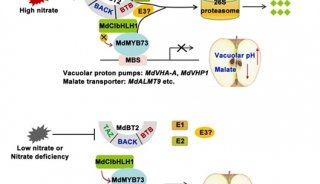
-
项目成果
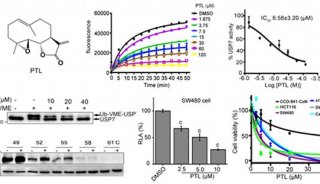
-
项目成果
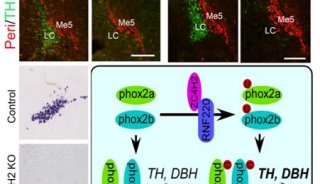
-
项目成果
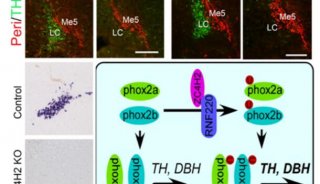
-
项目成果
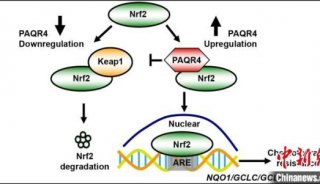
-
焦点事件

-
项目成果

-
项目成果
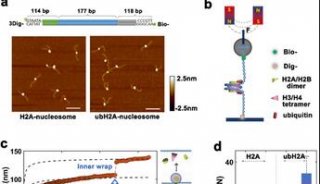
-
焦点事件

-
项目成果
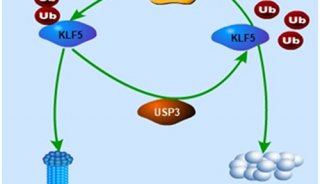
-
焦点事件

-
项目成果
-
项目成果
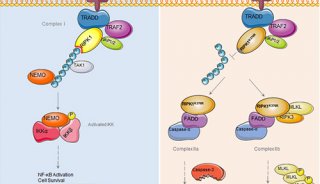
-
项目成果
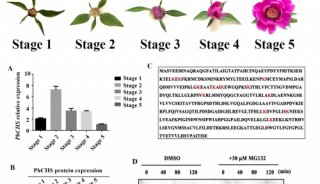
-
项目成果
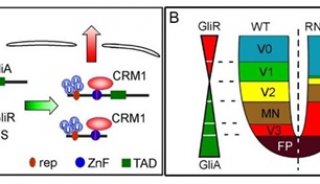
-
项目成果
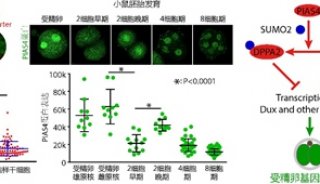
-
项目成果
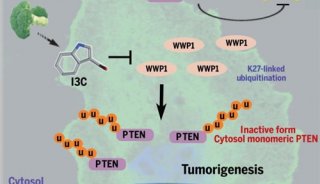
-
项目成果

-
项目成果
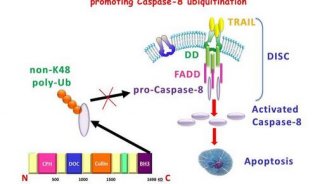
-
焦点事件

-
焦点事件

-
项目成果

-
项目成果
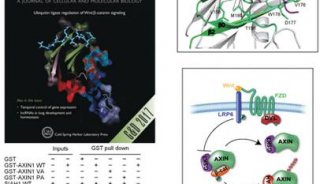
-
科技前沿