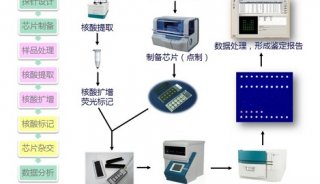
分子生物学常用实验技术(十二)
第九章分子杂交技术
互补的核苷酸序列通过Walson-Crick 碱基配对形成稳定的杂合双链分子DNA
分子的过程称为杂交。杂交过程是高度特异性的,可以根据所使用的探针已知序列进行特异性的靶序列检测。杂交的双方是所使用探针和要检测的核酸。该检测对象可以是克隆化的基因组DNA,也可以是细胞总DNA
或总RNA。根据使用的方法被检测的核酸可以是提纯的,也可以在细胞内杂交,
即细胞原位杂交。探针必须经标记,以便示踪和检测。使用最普遍的探针标记物是同位素,
但由于同位素的安全性,近年来发展了许多非同位素标记探针的方法。核酸分子杂交具有很高的灵敏度和高度的特异性,因而该技术在分子生物学领域中已广泛地使用于克隆基因的筛选、酶切图谱的制作、基因组中特定基因序列的定性、定量检测和疾病的诊断等方面。因而它不仅在分子生物学领域中具有广泛地应用,而且在临床诊断上的应用也日趋增多。
第一节核酸探针标记的方法
核酸探针根据核酸的性质,可分为DNA
和RNA
探针;根据是否使用放射性标记物的与否,可分为放射性标记探针和非放射性标记探针;根据是否存在互补链,可分为单链和双链探针;根据放射性标记物掺入情况,可分为均匀标记和末端标记探针。下面将介绍各种类型的探针及标记方法。
一、双链DNA 探针及其标记方法
分子生物研究中,最常用的探针即为双链DNA 探针,它广泛应用于基因的鉴定、临床诊断等方面。双链DNA 探针的合成方法主要有下列两种:切口平移法和随机引物合成法。
1.
切口平移法(nick translation) 当双链DNA 分子的一条链上产生切口时,E.coli DNA
聚合酶Ⅰ就可将核苷酸连接到切口的3'羟基末端。同时该酶具有从5'→3'的核酸外切酶活性,能从切口的5'端除去核苷酸。由于在切去核苷酸的同时又在切口的3'端补上核苷酸,从而使切口沿着DNA
链移动,用放射性核苷酸代替原先无放射性的核苷酸,将放射性同位素掺入到合成新链中。最合适的切口平移片段一般为50-500
个核苷酸。切口平移反应受几种因素的影响: 产物的比活性取决于[α-32 P]dNTP 的比活性和模板中核苷酸被置换的程度。DNA
酶Ⅰ的用量和E.coli DNA 聚合酶的质量会影响产物片段的大小。DNA 模板中的抑制物如琼脂糖会抑制酶的活性, 故应使用仔细纯化后的DNA。
材料: 待标记的DNA。
设备:高速台式离心机,恒温水浴锅等。
试剂:
(1)10×切口平移缓冲液:0.5mol/L Tris?Cl (pH7.2); 0.1mol/L MgSO4 ; 10mmol/L DTT; 100μg/ml
BSA。
(2)未标记的dNTP 原液:除同位素标记的脱氧三磷酸核苷酸外,其余3 种分别溶解于50mmol/L
Tris?Cl (pH7.5)溶液中,浓度为0.3mmol/L。
(3)[α-32 P] dCTP 或[α-32 P]dATP:400 Ci/mmol, 10μCi/μl。
(4) E.coli DNA 聚合酶Ⅰ(4 单位/μ l):溶于50μ g/ml BSA, 1mmol/L DTT, 50%甘油,50mmol/L
Tris?Cl(pH7.5)中。
(5)DNA 酶Ⅰ:1mg/ml。
EDTA :200mmol/L (pH8.0)。
(7)10mol/L NH4Ac。
操作步骤:
(1) 按下列配比混合:
未标记的dNTP 10μl
10×切口平移缓冲液5μl
待标记的DNA 1μg
[α-32 P]dCTP 或dATP(70μCi) 7μl
E.coli DNA 聚合酶4 单位
DAN 酶I 1μl
加水至终体积50μl
(2) 置于15℃水浴60 分钟。
(3) 加入5μl EDTA 终止反应。
(4) 反应液中加入醋酸铵,使终浓度为0.5mol/L, 加入两倍体积预冷无水乙醇沉淀回收DNA探针。
[注意] 1、3H,32P 及35S 标记的dNTP 都可使用于探针标记,但通常使用[α-32 P]-dNTP。
2、DNA 酶Ⅰ的活性不同,所得到的探针比活性也不同,DNA 酶Ⅰ活性高,则所得探针比活性高,但长度比较短。
2.
随机引物合成法随机引物合成双链探针是使寡核苷酸引物与DNA 模板结合,在Klenow 酶的作用下,合成DNA
探针。合成产物的大小、产量、比活性依赖于反应中模板、引物、dNTP 和酶的量。通常,产物平均长度为400-600
个核苷酸。利用随机引物进行反应的优点是:(1)Klenow
片段没有5'→3'外切酶活性,反应稳定,可以获得大量的有效探针。(2)反应时对模板的要求不严格,用微量制备的质粒DNA
模板也可进行反应。(3)反应产物的比活性较高,可达4×109 cpm/μg 探针。(4)随机引物反应还可以在低熔点琼脂糖中直接进行。
材料:待标记的DNA 片段。
设备:高速台式离心机,恒温水浴锅等。
试剂:
(1)随机引物(随机六聚体或断裂的鲑鱼精子DNA)。
(2)10×随机标记缓冲液:900mmol/L HEPES (pH6.6); 10mmol/L MgCl2。
(3)Klenow 片段。
(4)20mmol/L DTT。
(5)未标记的dNTP 溶液:dGTP、dCTP 和dTTP 溶液,各5mmol/L。
[α-32 P] dATP:比活性>3000Ci/mmol, 10μCi/μl。
(7)缓冲液A:50mmol/L Tris?Cl (pH7.5); 50mmol/L NaCl; 5mmol/L EDTA (pH8.0); 0.5%
SDS。
操作步骤:
(1) 200ng 双链DNA(1μl)和7.5ng 随机引物(1μl)混合后置于eppendorf 管内,水浴煮沸5 分钟后,立即置于冰浴中1 分钟。
(2) 与此同时,尽快在一置于冰浴中的0.5ml eppendorf 管内混合下列化合物:
20mmol/L DTT 1μl
未标记的dNTP 溶液1μl
10×随机标记缓冲液1μl
[α-32 P] dATP(比活性>3000Ci/mmol; 10μCi/μl) 3μl
ddH2O 1μl
(3) 将步骤(1)eppendorf 管中的溶液移到步骤(2)管中。
(4) 加入5 单位(约1μl) Klenow 片段, 充分混合,在微型离心机中以12000g 离心1-2 秒, 使所有溶液沉于试管底部,在室温下保温3-16 小时。
(5) 在反应液中加入10μl 缓冲液A 后,将放射性标记的探针保存在-20℃下备用。同时计算放射比活性。
[注意]1、引物与模板的比例应仔细调整,当引物高于模板时,反应产物比较短,但产物的累积较多;反之,则可获得较长片段的探针。
2、模板DNA 应是线性的,如为超螺旋DNA,则标记效率不足50%。
二、单链DNA 探针
用双链探针杂交检测另一个远缘DNA
时,探针序列与被检测序列间有很多错配。而两条探针互补链之间的配对却十分稳定,即形成自身的无效杂交,结果使检测效率下降。采用单链探针则可解决这一问题。单链DNA
探针的合成方法主要有下列两种1) 以M13 载体衍生序列为模板,用Klenow 片段合成单链探针; (2) 以RNA 为模板,
用反转录酶合成单链cDNA 探针。
1. 从M13 载体衍生序列合成单链DNA 探针合成单链DNA
探针可将模板序列克隆到噬粒或M13噬菌体载体中,以此为模板,以特定的通用引物或以人工合成的寡合苷酸为引物, 在[a-32P]-dNTP
的存在下,由Klenow
片段作用合成放射标记探针,反应完毕后得到部分双链分子。在克隆序列内或下游用限制性内切酶切割这些长短不一的产物,然后通过变性凝胶电泳(如变性聚丙烯酰胺凝胶电泳)将探针与模板分离开。双链RF
型M13 DNA 也可用于单链DNA 的制备,选用适当的引物即可制备正链或负链单链探针。
材料:已制备好的单链DNA 模板(方法参见第十章中有关内容)。
设备:高速台式离心机,恒温水浴锅等。
试剂:
(1)10×Klenow 缓冲液:0.5mol/L NaCl, 0.1mol/L Tris?Cl(pH7.5); 0.1mol/L MgCl2。
(2)0.1mol/L DTT 溶液。
(3) [α-32 P] dATP:3000Ci/mmol, 10μCi/μl。
(4)40mmol/L 和20mmol/L 的未标记的dNTP 溶液。
(5)dCTP,dTTP,dGTP 各20mmol/L 的溶液。
Klenow 片段(5 单位/ml)。
(7)适宜的限制酶,如EcoRⅠ、HindⅢ等。
0.5mol/L EDTA (pH8.0)。
操作步骤:
(1)在0.5ml eppendorf 管中混合如下溶液:
单链模板(约0.5pmol) 1mg
适当引物5pmol
10×Klenow 缓冲液3ml
加水至20ml
(2)将eppendorf 管加热到85℃ 5 分钟,在30 分钟内,使小离心管降到37℃;
(3)依次加入:
DTT 2ml
[a-32P]dATP 5ml
未标记的dATP 1ml
dGTP,dCTP,dTTP 混合液1ml
混合均匀后,稍离心使之沉于试管底部。
(4)加1ml(5 单位)Klenow 酶室温下30 分钟。
(5)加1ml20mmol/L 未标记的dATP 溶液20 分钟。68℃加热10 分钟,使Klenow 片段失活。调整NaCl 浓度,使之适宜于酶切。
(7)加入20 单位限制性内切酶(如EcoRⅠ, HindⅢ等)酶切1 小时。酚/氯仿抽提DNA,乙醇沉淀以去除dNTP 或加0.5mol/LEDTA(pH8.0)至终浓度10mmol/L。
(9)用电泳方法分离放射性标记的探针。
-
焦点事件

-
焦点事件

-
焦点事件

-
综述