中山大学荒漠特殊生境微生物暗物质资源研究发NPJ
近日,中山大学教授李文均团队在荒漠特殊生境微生物暗物质资源研究方面取得重要进展。相关成果发表于npj Biofilms and Microbiomes。

论文第一作者、中山大学-嘉应学院联合基地博士后李帅表示,荒漠约占全球陆地总面积的1/3,是地球上面积最大、研究最不充分的生境之一,同时也是地球微生物多样性的重要宝库。对荒漠生态系统的微生物多样性、组成和功能进行剖析,将有助于了解旱地生命带来的全球变化、威胁与机遇。
该研究以挖掘沙漠土壤微生物暗物质为例,提出了一种融合了培养组学和宏基因组学方法(全长16S rRNA扩增子和鸟枪法测序)的多组学研究策略,即基于培养组的宏基因组学(CBM)。研究结果表明,将高分辨率的CBM方法与直接宏基因组测序相结合,能够深入剖析和挖掘沙漠土壤中的微生物暗物质资源。
论文共同通讯作者李文均表示,尽管基于直接宏基因组学测序或培养组学的微生物组学研究不断取得令人振奋的重要发现,但这两种技术目前仍存在诸多局限性。在此之前,尚未有结合培养组学和培养富集宏基因组测序两种方法对沙漠微生物组进行挖掘的研究报道。
作为一种整合的多组学研究策略,CBM能够通过提高ASVs和高/中质量MAGs的恢复率,极大提高沙漠土壤微生物组的分类和功能分辨率,并且重要的是它能在宏基因组测序结果的指导下对感兴趣的微生物进行恢复性分离。得益于物种水平的分析,研究还揭示了沙漠土壤中尚未被充分开发的细菌新资源的巨大潜力。
此外,多重条件组合下的培养组学实验结果为分离沙漠土壤中某些特殊或新的细菌类群也提供了重要参考。有了这些数据,我们能更好地了解沙漠微生物的群落组成和分布、微生物之间的相互作用、环境适应机制以及物种基因库。
“基于培养组的宏基因组学,为深入认识和挖掘微生物组样本中的暗物质资源提供了一个新的视角,尤其是那些来自于极端或特殊生境的样本。”李文均说。
相关论文信息:https://doi.org/10.1038/s41522-023-00439-8
摘要
沙漠占据地球陆地表面的三分之一,是微生物生物多样性的潜在重要库,但大多数沙漠微生物仍未被描述,被视为“微生物暗物质”。在这里,我们介绍了一种多组学策略,即基于文化组学的宏基因组学(CBM),它集成了大规模培养,全长16S rRNA基因扩增子和鸟枪式宏基因组测序。结果表明,CBM通过提高扩增子序列变异(ASV)和高质量/中等质量宏基因组组装基因组(MAG)的回收率,捕获了直接测序中遗漏的大量分类和功能多样性。重要的是,煤层气允许事后恢复感兴趣的微生物(例如,新型或特定的分类群),即使是那些在培养物中丰度极低的微生物。此外,基于煤层气和直接测序的菌株水平分析表明,沙漠土壤中蕴藏着相当数量的新型候选细菌(1941年,51.4%),其中1095种(来自煤层气)是可培养的。然而,CBM不能准确反映原位环境中真实微生物组成和功能途径的相对丰度,其使用与直接宏基因组测序相结合,可以更深入地了解沙漠微生物组。总体而言,本研究以高分辨率体现了CBM策略,是深入探索荒漠土壤中未开发的新型细菌资源的理想途径,并大大扩展了我们对隐藏在广袤沙漠中的微生物暗物质的认识。
介绍
沙漠是地球上最大和研究最不足的生物群落之一,约占全球陆地表面总量的三分之一1,是地球微生物多样性的重要宝库2.沙漠微生物在维持生态稳定和生物地球化学循环方面发挥着重要作用。对沙漠生态系统的微生物生物多样性、组成和功能进行剖析将有助于了解旱地生物带来的全球变化、威胁和机遇。3.此外,许多研究表明,沙漠栖息地中多样化的微生物群落可以产生一系列令人印象深刻的新型生物活性化合物,包括抗菌、抗炎、抗肿瘤和抗群体感应候选药物等。4,5,6,7,8.然而,由于生态位特化程度强,取样困难,常规培养方法适应性有限,大部分沙漠微生物在实验室中被忽视培养和表征9.微生物多样性的这一大块但尚未得到充分开发的部分代表了大量未充分开发和未表征的生物资源,俗称“微生物暗物质”10,11,这是微生物生态学和生物资源开发的根本障碍12,13.
宏基因组方法(例如,16S扩增子和鸟枪测序)提供了相对简单和快速的方法来分析微生物群落的分类组成和功能潜力,并在无需培养的情况下恢复全基因组序列14.最近对沙漠微生物组的宏基因组学调查大大促进了我们目前对全球沙漠中微生物种群组成和功能的理解。15、16、17 ,如阿塔卡马沙漠18,19,20,21, 纳米布沙漠22、23、24 , 内盖夫沙漠25,26, 古尔班通古特沙漠27和极地沙漠28,29为进一步深入勘探荒漠微生物资源奠定了重要基础。然而,来自环境样本的宏基因组数据的有用性在很大程度上取决于群落的复杂性和生物量、测序技术和参考数据库等。30、31、32 ,这可能导致遗漏某些特定分类群,例如丰度低的分类群。
培养组学将多种培养条件与16S rRNA基因扩增子测序和/或其他技术相结合,大大提高了我们对可培养微生物多样性的理解33,34.尽管培养组学在获得微生物纯培养物方面具有很大的实用性,但它通常被认为是劳动和资源密集型方法,并且可能忽略微生物群落中重要的特定目标群体35.因此,通过系统培养组学生成全面的菌株收集仍然是一个重要且尚未解决的挑战36.
值得注意的是,选择性培养物富集策略以降低群落复杂性可能有助于特定环境生物群落的宏基因组研究14(例如,肠道37,38).然而,没有研究联合使用培养组学和富含文化的宏基因组测序来研究沙漠微生物组。鉴于现有知识,我们假设基于大规模培养方法和高分辨率分析的富含培养物的宏基因组测序能够在很大程度上填补直接测序中土壤微生物组的缺失部分。综合考虑,我们的主要目的是评估培养组学和宏基因组学相结合的多组学策略在荒漠土壤微生物组研究中的有效性和前景,并为探索荒漠土壤中的微生物暗物质提供新的视角。
以沙漠土壤中微生物暗物质的挖掘为例,我们提出了一种融合培养和宏基因组方法(全长16S扩增子和鸟枪测序)的综合策略,即基于文化组学的宏基因组学(CBM)(图)。1). 本研究结果揭示了荒漠土壤中新型细菌资源未开发潜力的未被描述的景观,并证明了CBM在提高荒漠微生物组的分类和功能分辨率方面的巨大优势,这将扩展对隐藏在沙漠中的微生物暗物质的认识。
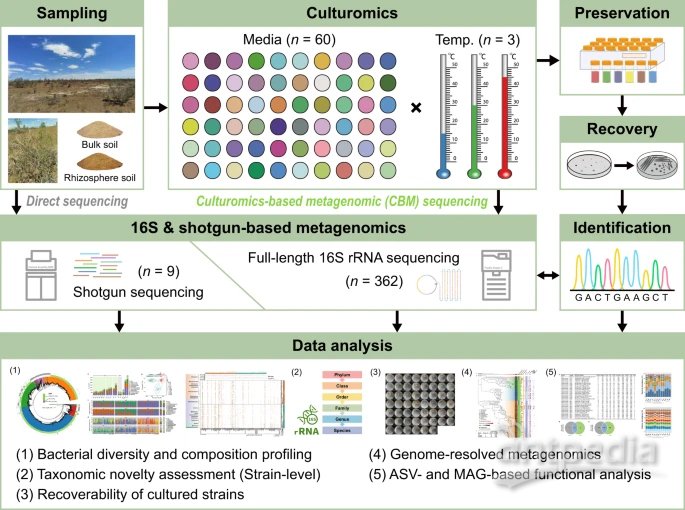
通过预实验选择白芷的块土和根际土壤(n = 2)(见补充图)。10),然后将它们接种到60种不同的培养基上并在15、30和45°C下孵育,其中在360个亚组中产生6个培养物:BCL(15°C的块土培养物),BCM(30°C的块土培养物),BCH(45°C的块土培养物),RCL(15°C的根际培养物),RCM(30°C的根际培养物)和RCH(45°C的根际培养物)。对两个原始土壤样品和16个富含培养物的样品进行了PacBio SMRT全长360S rRNA基因测序。此外,对两个原始土壤和七个选定的富含培养物的样品进行了鸟枪法宏基因组测序。将每个富含培养物的样品储存在-25°C的甘油(80%,v / v)中,其中两个(BM11和RM11分别在30°C下通过散装和根际土壤在M11琼脂上培养)用于第二轮恢复性分离。
-
焦点事件
-
科技前沿

-
招标采购

-
市场商机

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
招标采购

-
企业风采

-
项目成果

-
项目成果
-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
招标采购
-
项目成果

-
实验室动态

-
招标采购

-
招标采购

-
焦点事件

-
综述