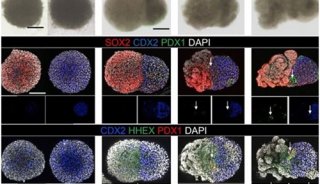
DNA羟化酶Tet1可取代外源Oct4促进体细胞重编程
2013年4月5日,北京生命科学研究所高绍荣博士实验室首次发现Tet1和5hmC在iPS细胞诱导过程中参与内源Oct4基因的去甲基化和激活,并且进一步证明Tet1可以取代外源Oct4实现安全高效的体细胞重编程。相关研究论文发表在近期出版的《Cell Stem Cell》杂志上。该文章被选为本期杂志的封面文章。
封面设计以帆船和航海图为寓意蓝本对重编程过程以及Tet1作用进行的艺术再现。寻宝(多能性)的航行旅程,可以经由一系列不同的路线,以及通过不同岛屿(屏障)的方式完成。在瞭望塔(Tet1)的指引下,桨(转录因子)和帆(DNA修饰动力学)协同工作,可以使整个航程变得更安全,也更快。
诱导多能干细胞(iPS)是通过在分化的体细胞中过表达特定转录因子,如Oct4(O),Sox2(S), Klf4(K), c-Myc(M)而实现体细胞重编程。高绍荣实验室在2009年通过四倍体补偿实验,获得了完全由OSKM iPS细胞发育来的小鼠,从而证明了iPS细胞具有真正多能性。在随后的几年里实验室一直致力于研究体细胞重编程过程中的表观遗传机制。DNA甲基化修饰由DNA甲基转移酶催化产生,主要产物为5-甲基胞嘧啶(5mC)。作为一种重要的表观遗传修饰,DNA甲基化广泛参与基因表达的调控,组蛋白修饰的建立等过程。在体内和体外的多种重编程过程中,DNA甲基化的去除,对于全能性基因的激活和组蛋白修饰的重建十分重要。然而,DNA去甲基化的分子机制一直不清楚。近年来,研究发现Tet家族可以催化5mC的氧化生成5hmC,从而进一步通过不同途径实现主动去甲基化或被动去甲基化。最新的研究证明Tet3介导的5mC的羟基化对于受精过程的DNA去甲基化和重编程具有重要作用;Tet1和Tet2也被认为参与了PGC发育过程以及细胞融合介导的重编程过程中特异位点的去甲基化。对于转录因子介导的体细胞重编程过程中,Tet是否参与内源全能性基因的去甲基化和重新活化并不清楚。
高绍荣实验室通过研究首次证明了5hmC和Tet1参与了传统iPS诱导(OSKM)过程中核心多能基因Oct4的去甲基化和表达激活。过表达Tet1可以促进Oct4转录控制区域5hmC的产生,进一步促进该区域的去甲基化和活性组蛋白信号的获得,实现Oct4的提前激活,进而促进重编程的发生。过表达Tet1更能够取代传统iPS诱导中最重要的转录因子Oct4,在其他因子辅助下成功实现体细胞的重编程(TSKM)。他们随后发现,通过四倍体囊胚补偿可以获得完全由TSKM iPS细胞发育来的小鼠,这些TSKM iPS小鼠能健康成长并正常繁殖。与OSKM来源的iPS小鼠具有很高的肿瘤发生率不同,这些TSKM iPS小鼠不会发生肿瘤。进一步研究发现,与传统的OSKM iPS细胞(5mC高,5hmC低)相比,TSKM iPS细胞的甲基化和羟甲基化水平更接近于胚胎干细胞(ESC)。表明TSKM诱导方法可能更有利于产生低致癌潜能的iPS细胞。
他们进一步利用TSKM iPS小鼠的成纤维细胞建立了TSKM的二次诱导体系进行机制研究。他们发现这个体系能够实现更高效率的重编程。通过各种实验手段以及高通量分析,他们发现5hmC参与了多个重要的多能性基因和多能性有关的活性调控区域的去甲基化,而重编程过程中独特的5mC与5hmC的动态变化模式,可能参与了基因组上的转录调控。这表明DNA甲基化和羟甲基化的改变可能直接影响着细胞全能性的重新获得。
总之,这项研究不仅证明了Tet1和5hmC可以促进传统iPS诱导中Oct4去甲基化和重新激活,更为体细胞重编程提供了新的选择,即通过过表达Tet1,直接推动DNA修饰的转变来促进细胞全能性的获得。细胞DNA修饰水平分析和小鼠癌症发生的研究,表明TSKM诱导可能通过提高DNA羟甲基化降低iPS细胞的致癌风险。这为提高iPS细胞应用的安全性提供了重要途径。
高绍荣实验室的博士生高亚威和陈嘉瑜为本文共同第一作者,高绍荣博士和蔡涛博士为此文的共同通讯作者。中国科学院生态环境研究中心的汪海林博士和学生黄华也有重要贡献。参与该工作的还有学生李珂,吴彤,刘文强,蒋永华,陆志伟,徐子健,康岚,陈珺;以及技术员黄波,寇晓晨,张郁,姚超,刘晓蕾。该研究在北京生命科学研究所完成,研究得到科技部和北京市政府的资助。
本文的发表引起业内的关注。《Cell Stem Cell》在“preview”栏目中,邀请Wisconsin大学的Rupa Sridharan教授等同期发表评论文章“The Nexus of Tet1 and the Pluripotency Network”,特别推介本文。评论文章认为:本文不仅检测了在转录因子诱导的体细胞重编程过程中,Tet1对于多能基因的羟甲基化和去甲基化中的重要作用,更通过Tet1取代Oct4建立了高效的TSKM二次诱导体系;在这一系统上提高Tet1表达量的研究进一步揭示了Tet1的重要作用。评论文章进一步认为:本文与近期发表的其他文章展现了细胞多能性调控网络建立与DNA羟甲基化状态的联系,这种联系的揭示将开辟未来研究的新领域,并引发对于新问题的探讨,例如Nanog/Tet在随机状态向最终状态发展中的作用,以及OSKM与TSKM诱导过程中分子机制的比较等。
-
企业风采

-
企业风采

-
产品技术
-
项目成果

-
科技前沿

-
科技前沿
-
科技前沿

-
技术原理
-
技术原理

-
科技前沿
-
技术原理

-
焦点事件
-
项目成果

-
项目成果