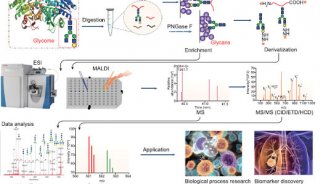
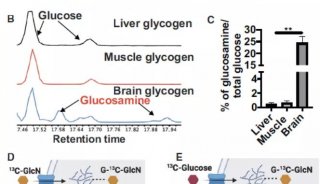
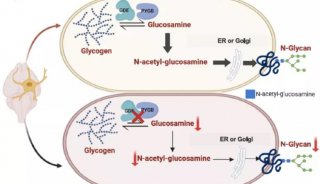
控制融合蛋白生产中的糖基化生成有潜力的biobetter
制药公司的管线充满了生物药物。许多是创新的治疗蛋白质,但越来越多的代表生物仿制药和biobetters(图1)(1)。biobetters通常被定义为“基于创新生物制品,但具有改进的性质”(2)。 他们的发展受益于已知的治疗方法和作用机制,从而导致低风险,快速通向临床,从而降低成本。优势是通过延长半衰期(t1/2),改善功效,降低免疫原性或毒性(3)。一些理想的改进,例如增强的药代动力学,可以通过将其他结构域与目标蛋白基因连接来获得(4)。例如,几种半衰期得到改善的融合蛋白最近已经获得市场批准,被用作凝血因子IX(FIX)或胰高血糖素样肽1(GLP-1)(表1)。

糖基化
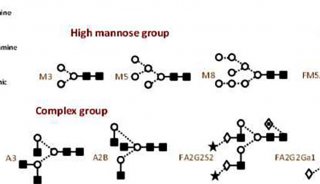
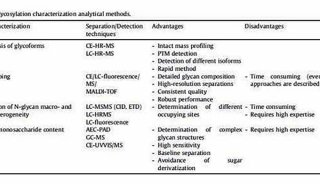
或者,可以应用糖基化修饰来增强循环时间。糖基化是真核细胞中的翻译后修饰,其影响许多生物相关功能,例如药代动力学,药效学和免疫原性。因此,在制造过程中,必须正确控制糖基化。糖基化蛋白质含有与天冬酰胺侧链中的氮N-连接的碳水化合物或与丝氨酸或苏氨酸中的氧O-连接的碳水化合物。在穿过内质网(ER)和高尔基体时,N-连接的聚糖以三步法连接。合成前体低聚糖,然后转移到天冬酰胺作为活化聚合物嵌段,最后酶修剪。这一步对培养条件非常敏感,因此N-聚糖需要更彻底的分析。该过程可以区分甘露糖含量高的聚糖,含有高度唾液酸的复杂寡糖和混合型(图2)。
与Asn的N-连接糖基化需要天冬酰胺-X-丝氨酸 -苏氨酸(Asn-X-Ser/Thr)的识别基序,其中X可以是除脯氨酸以外的任何氨基酸。 O-连接的糖基化不需要共有序列,而是需要更依赖于Ser或Thr的二级结构和可及性。 而且,O-连接的糖在高尔基体中依次作为单一的单糖连接。 随后通过糖基转移酶修饰导致成熟的O-聚糖。
O-连接的低聚糖中的末端糖通常是唾液酸。 唾液酸有几种变体,但只有NANA(N-乙酰神经氨酸)对半衰期有正面影响。 注意N-或O-连接聚糖的最终结构与蛋白质序列无关,而是取决于正确的三维结构以及必需酶的表达和ER和高尔基体中糖底物的可用性(5)。 这最终导致聚糖结构的异质性,增加了下游加工(DSP)和分析努力以产生均匀和良好表征的药物物质。
糖基化的作用
半衰期受糖基化的影响。大的寡糖结构的添加可以显著增加糖蛋白的流体动力学半径,从而降低肾过滤的水平,这是尺寸依赖性的。唾液酸对半乳糖残基的完全封闭实现三个功能:在肾小球滤过中的排斥由于负电荷,通过无唾液酸糖蛋白受体结合阻止消除,并增加流体动力学半径,从而更大程度上防止尺寸依赖性过滤(6)。因为唾液酸存在于N-连接的或O-连接的聚糖上,所以两种变体都可以显着延长半衰期。
例如,依那西普的循环时间与TNFα受体结构域的唾液酸化程度直接相关(7)。对于BR3-Fc-融合蛋白的O-连接聚糖以及IL-23R-Fc-融合蛋白,CTLA4-Ig融合蛋白,LFA3-Fc-融合蛋白和TNFαRI-Fc-融合蛋白中的N-连接聚糖的唾液酸化表现出相同的效果(8)。
糖基化也可以减少半衰期。对于甘露糖含量高的案例,蛋白质通过巨噬细胞和肝细胞上的甘露糖受体迅速从血液中清除。具体而言,M5变体种类被清除最快(9)。另一方面,具有高甘露糖含量的糖蛋白可以用于治疗性蛋白质靶向特定的细胞类型。用于溶酶体贮积病的酶替代疗法依赖于该原理,特别是针对巨噬细胞。第一种酶药物必须进行化学改造,但是现在表达系统的正确选择可以提供具有高甘露糖含量的糖蛋白(10)。
抗体依赖性细胞介导的细胞毒性(ADCC)是适应性免疫应答的一部分,并且描述了免疫细胞对其表面抗原与抗体结合的靶细胞的攻击。抗体和效应细胞之间的连接取决于在IgG的CH2结构域的重链 -在免疫球蛋白与Fcγ受体相互作用的区域的Asn297位置存在某种N-连接的糖基化。在此位置不存在糖基化减少了与FcγRI的结合亲和力,并完全消除与FcγRII和FcγRIII的结合。然而,如果仅从聚糖中去除岩藻糖,则抗体显示出对FcγRIIIa 增加的亲和力,因为在抗体上的碳水化合物和受体之间没有空间位阻(11)。
末端半乳糖是补体依赖性细胞毒性(CDC)活性的关键元件。 CDC与利妥昔单抗重链中的半乳糖含量成比例地增加,而与C1q的亲和力已经显示出从G0增加到G2糖的两倍(12)。沈等人描述了一种biobetter版本的依那西普,它能改善与膜结合的TNFα的结合,并表现出作为新的作用模式的ADCC活性[13]。该发现可以导致进一步改进的受体陷阱和其他糖基化工程化的含Fc结构域的融合蛋白而不改变氨基酸序列。
毒性:在微生物或植物毒素与靶向部分(如单链抗体)融合以产生免疫毒素的情况下,研究显示非糖基化的白喉毒素比具有N-连接的聚糖的天然毒素的毒性高12倍。因此,识别序列中的天冬酰胺被丙氨酸取代以获得毒性融合蛋白(14)。
免疫原性:在糖基化期间添加的大量碳水化合物结构可能会使免疫原性肽表位免受免疫系统的识别。然而,非人或非哺乳动物的聚糖如高甘露糖N-聚糖或N-羟乙酰神经氨酸(Neu5Gc)和半乳糖-α1,3-半乳糖(α-Gal)会引起免疫反应。 α-Gal表位或Neu5Gc的结构已被描述为抗药物抗体(ADA)的靶标(15)。
溶解性和稳定性:疏水性蛋白质斑块提供了聚糖的屏蔽作用。糖结构的高亲水含量增加了溶解度。它也有助于热稳定性,因为热诱导展开后蛋白质通常趋向于通过疏水斑块聚集(16)。另一个保护聚糖结构的功能是蛋白酶的空间位阻,从而限制了降解(17)。图3显示了典型的聚糖结构及其功能。
控制糖基化
分子设计:操纵聚糖含量的第一步是通过适应氨基酸序列。Darbepoetin alfa(Aranesp)是含有5个(而不是3个)N-连接的糖基化位点的人促红细胞生成素(EPO)的高糖基化类似物。
这种新的变体展现出相对旧的变体更低的pI(3.3 代替4.0),更大的分子量(37kDa代替30kDa)和增加的碳水化合物含量(51%代替40%)。半衰期从8.5小时显着增加至26.3小时。虽然五个氨基酸发生了变化,但ADA的数量并没有增加,这可能是由于聚糖对新表位的屏蔽(18)。
类似的情况是凝血因子VIIa(FVIIa)的糖工程(BAY 86-6150)。在FVIIa的原始序列中引入了两个以上的N-连接的聚糖连接位点。这种修饰提高了野生型FVIIa半衰期的两倍至三倍半衰期(19)。
可以添加具有多个糖基化位点的肽序列。这个概念常用的构建模块是人绒毛膜促性腺激素(hCG)-β-亚基的C-末端肽(CTP)。该域包含四个O-连接的寡糖识别位点。尽管它的名字,CTP可以融合到N-或C-末端或两个末端。在一个实例中,将一个CTP单元融合到氨基末端,并将两个CTP结构域添加到EPO的羧基末端。由于来自CTP的84个氨基酸和大量的O-连接的寡糖,分子量增加到57kDa。半衰期增加了三倍,没有引发免疫反应(20)。相同原理通过在C端连接CTP应用于FVIIa。这种修改导致FVIIa-CTP(MOD-5014)(21)的三到五倍的半衰期改善。
另一种方法是使用聚唾液酸(PSA)。这通过将NCAM的PSA载体结构域融合到scFv的C端并在含有聚唾液酸转移酶的转基因HEK293细胞中表达该构建体来示例。聚唾液酸化使流体动力学半径增加了三倍,导致循环半衰期提高了12倍(22)。
通常,短肽片段在融合蛋白的结构域之间起着灵活的连接体的作用。 甘氨酸-丝氨酸(Gly-Ser)接头中的丝氨酸是O-连接的木糖基化的靶标。 这种聚糖可以是免疫原性的,所以通过用脯氨酸(Pro)取代邻近Ser的一个Gly来改变基序(23)。 在另一种情况下,去除O-连接的糖基化位点以恢复融合蛋白中抗IL17a肽的适当活性(24)。 在一项关于IgA铰链肽的研究中,研究人员证明O连接糖基化的增加降低了接头的灵活性并限制了接头的构象(25)。 然而,将糖基化位点引入接头结构域支持复杂的融合蛋白的正确折叠,因为它减慢蛋白质加工并包括细胞内质量控制,从而产生稳定的蛋白质。 图4显示了典型的构建块。
细胞系和应变
工程:下一级糖基化控制是宿主细胞系的选择。典型的生产宿主如中国仓鼠卵巢(CHO),人类胚胎肾(HEK293),PER.C6,NS0和SP2/0细胞在其聚糖模式中显著不同(表2)。 CHO细胞广泛用于制造蛋白质,因为它们递送人类型聚糖。然而,它们不能产生α-2,6-唾液酸化和α-1,3/4-岩藻糖基化,甚至不能连接一些非人类和免疫原性的聚糖如Neu5Gc和α-Gal。图5显示了宿主细胞的差异。
宿主的一些缺点可以通过菌种工程来消除,所述菌种工程是加入或去除糖基转移酶。不存在于人类中的酶,例如α-1,3-半乳糖基转移酶或CMP-Neu5Ac羟化酶尤其应该被敲除。消除CHO细胞中的α-1,6-岩藻糖基转移酶(FUT8)活性导致聚糖中不存在岩藻糖。这对于抗体和Fc融合蛋白来提高其ADCC能力是有益的(26)。
通过引入β1,4-甘露糖糖蛋白4-β-N-乙酰葡糖胺基转移酶III(GnTIII),可以改善ADCC,其阻断岩藻糖基化并导致平分天线。通过共表达微生物唾液酸酶A(其切割末端唾液酸残基)可以增强ADCC功能(27)。然而,通过RNA干扰消除CHO细胞中的唾液酸酶活性增加了唾液酸的总量(28)。通过过表达α-2,6-唾液酸转移酶可以恢复CHO细胞产生α-2,6唾液酸化的能力(29)。唾液酸化也可以通过引入一个基因,例如β-1,4半乳糖转移酶产生末端半乳糖的基因,然后转移唾液酸来提高(30)。
上游处理(USP)
聚糖结构可受生物反应器中生长条件的影响。具有效果的典型物理化学过程参数是pH,温度,CO2和铵离子浓度(表3)。渗透压的滴定可以用来控制岩藻糖基化的程度。重要的酶辅因子应该以足够的量存在。具体而言,锰和铁促进增加的糖基化。其他补料或培养基组分如典型的碳源葡萄糖,其被半乳糖,甘露糖或其它糖基化前体取代,对聚糖结构有影响,包括尿苷二磷酸-N-乙酰葡糖胺(UDP-GlcNAc),尿苷二磷酸-半乳糖(UDP-Gal)和胞苷一磷酸-唾液酸(CMP-SA)。
培养基中的添加剂也可以在上游加工期间引导糖基化。添加丁酸钠后,融合蛋白中Neu5Gc的免疫原性含量可降低50%。此外,后期的温度变化和NaOH控制的pH可以支持低Neu5Gc水平(31)。一项研究显示氢化可的松对糖皮质激素受体的激活改善了依赖于剂量的Fc-融合蛋白的唾液酸化程度(32)。
除了在基因水平的糖工程,不需要的酶活性可以被特定的抑制剂阻断。例如,岩藻糖基转移酶可被氟化岩藻糖类似物(33)或某些活性染料(34)所阻断。硫酸葡聚糖已经解决了唾液酸酶,而甘露糖苷酶1抑制剂被用来产生高甘露糖结构(35)。
下游处理
DSP通常以无细胞上清液开始。理想情况下,为了防止细胞内糖苷酶特别是可降低唾液酸含量的唾液酸酶的释放,不发生细胞裂解在收获过程中。尽管在USP期间有很多控制糖基化的可能性,通常仍然存在一些异质性。这些不同的异构体可以根据电荷变化在阴离子交换树脂上以缓梯度进行分离。负电荷主要由唾液酸贡献。由于其单独的疏水性程度,高度带电的形式也可以与不太强烈的糖基化变体区分开。该原理应用了高度糖基化的Fc融合蛋白,可以通过离子交换色谱和疏水相互作用色谱(HIC)的组合进行纯化(36)。
一般来说,聚糖可以比不含偶联寡糖的天冬酰胺更具亲水性,因此与HIC树脂结合更紧密(37)。在某些情况下,羟基磷灰石(HTP)已被用于区分聚糖变异体。例如,α1酸性糖蛋白(AAG)的六种亚型可以在低pH下用HTP和磷酸盐梯度分离(38)。 用于分析目的的树脂库甚至更大,还含有高特异性的亲和配体,例如凝集素或二氧化钛(39)。
展望:进度和优化
在过去的几十年中,在了解糖基化机制及其作用方面取得了巨大进展。一般而言,biobetter从优化聚糖的各种方法中受益(图6)。策略重点是延长循环半衰期,可以观察到一种改进功能的趋势。在融合蛋白的例子中,我们很可能会看到增强的fc融合蛋白,但还有一个警告:在这种情况下,糖化工程与能够产生类似效果的氨基酸交换竞争。生物制品行业的竞争日益激烈(图1和表1),表明不同的分子版本可以解决相同的市场问题,并且存在着很小的分化潜能。在许多情况下,糖基化是需要严格控制参数的关键质量属性。由于优化糖蛋白的复杂性和多种可能性,制造商应根据设计原则组织所有的努力,使系统的微调达到预期的效果。
-
项目成果
-
焦点事件

-
会议会展

-
投融资
-
产品技术
-
会议会展
-
项目成果
-
焦点事件

-
焦点事件

-
科技前沿
-
项目成果
-
会议会展

-
焦点事件

-
焦点事件

-
科技前沿
-
科技前沿

-
科技前沿
-
科技前沿
-
科技前沿

-
科技前沿

-
产品技术

-
焦点事件

-
焦点事件

-
会议会展

-
会议会展

-
焦点事件

-
会议会展

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
项目成果
-
焦点事件

-
会议会展

-
项目成果
-
项目成果
-
项目成果

-
项目成果
-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
项目成果
-
综述
-
科技前沿

-
综述