聚丙烯凝胶电泳的原理及优点
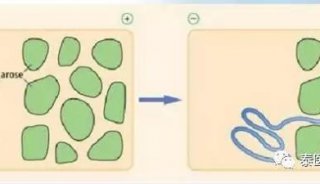
琼脂糖凝胶电泳是用琼脂糖作支持介质的一种电泳方法。其分析原理与其他支持物电泳的最主要区别是:它兼有“分子筛”和“电泳”的双重作用。
琼脂糖凝胶具有网络结构,物质分子通过时会受到阻力,大分子物质在涌动时受到的阻力大,因此在凝胶电泳中,带电颗粒的分离不仅取决于净电荷的性质和数量,而且还取决于分子大小,这就大大提高了分辨能力。但由于其孔径相当大,对大多数蛋白质来说其分子筛效应微不足道,现广泛应用于核酸的研究中。
蛋白质和核酸会根据pH不同带有不同电荷,在电场中受力大小不同,因此跑的速度不同,根据这个原理可将其分开。电泳缓冲液的pH在6~9之间,离子强度0.02~0.05为最适。常用1%的琼脂糖作为电泳支持物。琼脂糖凝胶约可区分相差100bp的DNA片段,其分辨率虽比聚丙烯酰胺凝胶低,但它制备容易,分离范围广。普通琼脂糖凝胶分离DNA的范围为0.2-20kb,利用脉冲电泳,可分离高达10^7bp的DNA片段。
操作流程
准备干净的配胶板和电泳槽
注意DNA酶污染的仪器可能会降解DNA,造成条带信号弱、模糊甚至缺失的现象。
选择电泳方法
一般的核酸检测只需要琼脂糖凝胶电泳就可以;如果需要分辨率高的电泳,特别是只有几个bp的差别应该选择聚丙烯酰胺凝胶电泳;用普通电泳不合适的巨大DNA链应该使用脉冲凝胶电泳。注意巨大的DNA链用普通电泳可能跑不出胶孔导致缺带。
正确选择凝胶浓度
对于琼脂糖凝胶电泳,浓度通常在0.5~2%之间,低浓度的用来进行大片段核酸的电泳,高浓度的用来进行小片段分析。低浓度胶易碎,小心操作和使用质量好的琼脂糖是解决办法。注意高浓度的胶可能使分子大小相近的DNA带不易分辨,造成条带缺失现象。
适合的电泳缓冲液
常用的缓冲液有TAE和TBE,而TBE比TAE有着更好的缓冲能力。电泳时使用新制的缓冲液可以明显提高电泳效果。注意电泳缓冲液多次使用后,离子强度降低,pH值上升,缓冲性能下降,可能使DNA电泳产生条带模糊和不规则的DNA带迁移的现象。
电泳的合适电压和温度
电泳时电压不应该超过20V/cm,电泳温度应该低于30℃,对于巨大的DNA电泳,温度应该低于15℃。注意如果电泳时电压和温度过高,可能导致出现条带模糊和不规则的DNA带迁移的现象。特别是电压太大可能导致小片段跑出胶而出现缺带现象
DNA样品的纯度和状态
是电压太大可能导致小片段跑出胶而出现缺带现象DNA样品的纯度和状态注意样品中含盐量太高和含杂质蛋白均可以产生条带模糊和条带缺失的现象。乙醇沉淀可以去除多余的盐,用酚可以去除蛋白。注意变性的DNA样品可能导致条带模糊和缺失,也可能出现不规则的DNA条带迁移。在上样前不要对DNA样品加热,用20mM NaCl缓冲液稀释可以防止DNA变性。
DNA的上样
正确的DNA上样量是条带清晰的保证。注意太多的DNA上样量可能导致DNA带型模糊,而太小的DNA上样量则导致带信号弱甚至缺失。TIANGEN公司DNA分子量标准每次上样6ul即可得到清晰均匀的条带。
Marker的选择
DNA电泳一定要使用DNA Marker或已知大小的正对照DNA来估计DNA片段大小。Marker应该选择在目标片段大小附近ladder较密的,这样对目标片段大小的估计才比较准确。TIANGEN公司的DNA Marker条带清晰,亮度均匀,质量稳定,是您实验的首选。需要注意的是Marker的电泳同样也要符合DNA电泳的操作标准。如果选择λDNA/HindIII或者λDNA/EcoRI的酶切Marker,需要预先65℃加热5min,冰上冷却后使用。从而避免HindIII或EcoRI酶切造成的粘性接头导致的片段连接不规则或条带信号弱等现象。
凝胶的染色和观察
实验室常用的核酸染色剂是溴化乙啶(EB),染色效果好,操作方便,但是稳定性差,具有毒性。而其他系列例如SYBR Green,GelRed,虽然毒性小,但价格昂贵。TIANGEN公司的GeneGreen相比则是性价比高的低毒替代染料,其灵敏度比传统EB染料高10倍以上。注意观察凝胶时应根据染料不同使用合适的光源和激发波长,如果激发波长不对,条带则不易观察,出现条带模糊的现象。
-
技术原理
-
焦点事件

-
焦点事件











