DNA重组技术:酶切、连接
实验原理:
DNA重组技术是用内切酶分别将载体和外源DNA切开,经分离纯化后,用链接酶将其连接,构成新的DNA分子。限制性内切酶能特异地结合于一段被称为限制性酶识别序列的DNA序列之内或其附近的特异位点上,并切割双链DNA。如EcoRⅠ切割识别序列后产生两个互补的粘性末端。
5’…G↓AATTC…3’ →5’… G AATTC…3’
3’…CTTAA↑G …5’ →3’… CTTAA G…5’
构建DNA限制性内切酶图谱有许多方法。通常结合使用多种限制性内切酶,通过综合分析多种酶单切及不同组合的多种酶同时切所得到的限制性片段大小来确定各种酶的酶切位点及其相对位置。酶切图谱的使用价值依赖于它的准确性和精确程度。
限制性内切酶的一个活性单位U
理论上, 1hr,切1ug DNA 样品中所有专一位点的所用酶量实际反应,1U酶:能完全切割1ul λDNA的一个位点不能完全 切割1ug 带有4个酶切位点的样品和不纯的样品.
如果采用两种限制性内切酶,必须要注意分别提供各自的最适盐浓度。若两者可用同一缓冲液,则可同时水解。若需要不同的盐浓度,则低盐浓度的限制性内切酶必须首先使用,随后调节盐浓度,再用高盐浓度的限制性内切酶水解。
限制性内切酶的使用注意事项:
10x bf o 无盐
注意混匀 L 低盐
H 高盐
一.仪器
水浴锅(37℃,65℃) 凝胶电泳 灭菌锅 紫外检测 离心机
二.试剂及溶液
λ DNA EcoR I
pUC18 无菌水
终止液 (40%蔗糖) 70%,100%酒精
3Mol/L KAc(pH5.2) ice
琼脂糖 溴酚蓝
TE TAE
EB marker
三. 用品
移液器20ul 一次性手套
tip 20ul 防护镜
离心管0.5ml 吸水纸
胶带 浮子
PUC 18/19, λDNA
2人/组,一人做 PUC18 酶切 (20ug) Takara 25ug/个
一人作λDNA 酶切 (15ug)
EcoR1 1ul/人 (10 u) (20ul) Takara 4000u/个
四:酶切反应:
DNA纯度、缓冲液、温度条件及限制性内切酶本身都会影响限制性内切酶的活性。大部分限制性内切酶不受RNA或单链DNA的影响。当微量的污染物进入限制性内切酶贮存液中时,会影响其进一步使用,因此在吸取限制性内切酶时,每次都要用新的吸管头.
[注意]
1.酶切时所加的DNA溶液体积不能太大,否则DNA溶液中其他成分会干扰酶反应。
2、酶活力通常用酶单位(U)表示,酶单位的定义是:在最适反应条件下,1小时完全降解1mg
λDNA的酶量为一个单位,但是许多实验制备的DNA不象
λDNA那样易于降解,需适当增加酶的使用量。反应液中加入过量的酶是不合适的,除考虑成本外,酶液中的微量杂质可能干扰随后的反应。
3、市场销售的酶一般浓度很大,为节约起见,使用时可事先用酶反应缓冲液(1×)进行稀释。另外,酶通常保存在50%的甘油中,实验中,应将反应液中甘油浓度控制在1/10之下,否则,酶活性将受影响。
37℃,2hr
终止反应 65℃ 10min
各取2ul酶解液,电泳
EcoRI切割λDNA后电泳得到6个片段,
长度分别为 21.2, 7.4, 5.8, 5.6, 4.9 和 2.5kb
-
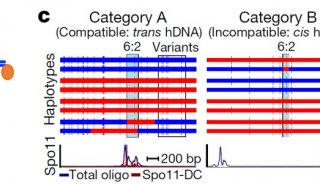
科技前沿
-
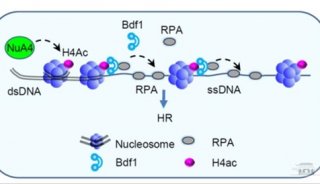
技术原理
-
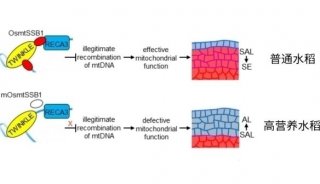
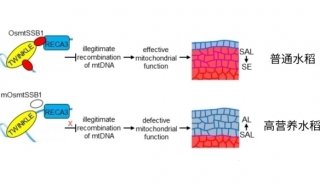
科技前沿
-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果