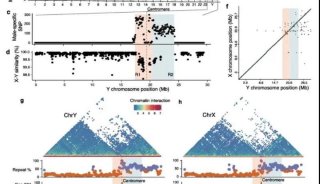
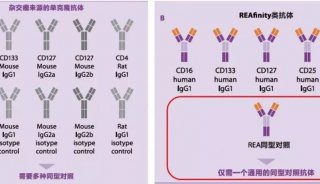
骨骼细胞染色体制备方法
1. 在含有细胞培养基的细胞培养管中无菌添加骨髓样本1ml(参考细胞密度<1×106/ml),盖紧培养瓶,充分混均;
2. 水平培养12, 24, 48h(37℃);
3. 加入4-5滴秋水溶液,培养一定时间;
4. 离心3-4 min(2000 rpm);
5. 去除上清液,保留0.5ml的细胞;
6. 重新充分混悬细胞1;
7. 加入5ml 低渗溶液(KCl 0.075M),室温低渗5-7min;
8. 重复4、5、6操作,用Ibraimov’s溶液混悬细胞;
9. 加入5 ml 调整过的Ibraimov’s 溶液1 2 (92ml H2O+5ml 冰乙酸+3ml 甲醇),混均,室温处理3-4 min;
10.重复4、5、6操作,用甲醇溶液混悬细胞1;
11.立即离心,重复4、5操作,用固定液混均细胞;
12.加入5 ml固定液1,重新混均3;
13.离心(1200 rpm) 5 min,去除全部上清液;
14.加入0.5ml新鲜配置的固定液混悬细胞3;
推荐:a. 滴片前将此样在室温下保持30min;
b. 使用新鲜配置的固定液;
15.滴片(干净的玻片),在Maxchrome仪器中分散染色体4。
1 使用混旋器,保证悬浮细胞的一致性。
2 产生均匀的褐色和泡沫表明此步操作非常成功。
3 如果样品暂时不滴片,请在冰箱中保存。
4 推荐以下操作,以达到最佳的染色体分散质量:
a) 如果看到中期细胞没有染色体(“broken metaphases”),表明RH值过高;
b) 如果染色体没有完全分散,细胞质背景较重,表明RH值偏低。
-
科技前沿

-
焦点事件

-
科技前沿
-
科技前沿
-
项目成果