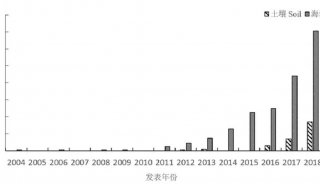
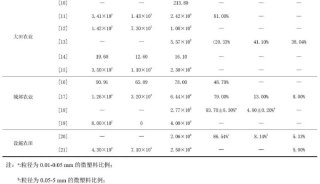
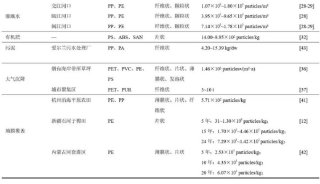
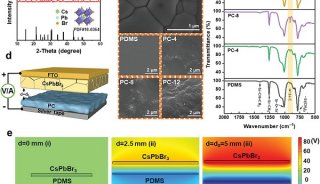
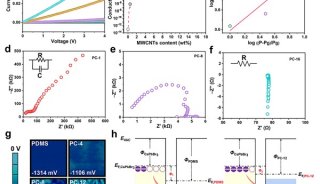
聚丙烯酰胺等电聚焦电泳测蛋白质的等电点-2
四、固定、,染色和脱色
将凝胶板放在培养皿中,加入固定液,浸泡数小时后,用脱色液清洗两次,每次10min, 然后加入染色液,室温下放置15-30min,再用脱色液洗脱数次,直至谱带清晰,放入保存液中浸泡10min,可制干板。
五、制作干胶板
1. 取完全浸湿的平整玻璃纸一张,于玻璃板上铺平,纸与板之间不可有气泡。
2. 将凝胶铺于上述玻璃纸上,对齐中心位置,使四边留出距离相等,随后将胶与纸之间的气泡轻轻赶跑。然后,把另一张玻璃纸折起盖在胶面上,并与下层玻璃纸对齐,胶与两层玻璃纸之间要绝对避免气泡,要求光滑平整。
3. 将凝胶四边上下两层玻璃纸贴紧,使胶边边缘上完全没有气泡。然后将各边的玻璃纸多余部分折向玻璃板反面。
4. 置于室温中自然干燥,完全干燥后的胶板,手感如触及玻璃板。这时,可将胶板揭下,裁去边角多余的纸,即可得一张图谱清晰的干胶板。
注意事项
(1)支持介质
在IEF-PAGE中,丙烯酰胺純度极为重要,Acr及Bis中如有丙烯酸,则引起聚焦后pH剃度漂移,一般需用重结晶法进一步纯化Acr及Bis。 最近Pharmacia公司推出Amberlite MB-6除去丙烯酸,其效果较再結晶法更佳。
(2)两性电解质载体
两性电解质载体是IEF-PAGE中最关键的试剂,直接影响pH梯度的形成,以及蛋白質
的聚焦。因此,要选用优质的两性电解质载体,在凝胶中,其终浓度一般为1-2%。pH梯度的线性依赖于两性电解质的性质,选择哪种pH梯度范围的两性电解质载体,則与被分离蛋白质的pI有关。
(3)样品预处理与加样方法
实验证实,盐离子可干扰pH梯度形成,并使区带扭曲。为了防止上述影响,进行IEF-PAGE时,样品应透析或用Sephadex
G-25脱盐,也可将样品溶解在水,或是低盐缓冲液中,使其充分溶解,以免不溶小顆粒引起拖尾。但某些蛋白质在等电点附近,或水溶液及低盐溶液中,溶解度较低,則可在样品中加入两性电解质,如加入1%甘氨酸或对1%甘氨酸透析,虽然甘氨酸是两性电解质,但不影响pH梯度的形成,可利用其在溶液中的偶极距作用增加蛋白質的溶解性。此外,还可在样品及凝胶溶液中加入无离子去污剂如Tween
80, Triton X-100, Nonide P-40等或加入相同浓度的尿素(4
M),以免氰酸盐引起蛋白质的胺甲酰化,含有尿素的样品及凝胶板只能当天使用。
加样量取决于样品中蛋白质的种类、数目及检测方法的灵敏度。如用银染色,加样量可减少到1 μg。一般样品浓度以0.5-3
mg/ml为宜,最适加样体积为10-30 μl。如样品很浓,可直接在凝胶表面加2-5
μl;如样品很稀,可加样300μl。值得注意的是:对不稳定的样品可先将凝胶进行15-30
min预电泳使pH梯度形成,然后将样品放再靠近pI的位置以缩短电泳的时间,但不要将样品正好加在pI处和紧靠阳、阴极的胶面上,以免引起蛋白质变性造成区带扭曲。一般加样电泳半小时后,取出加样滤纸以免引起拖尾現象。
(4)电功率、时间等因素
在IEF电泳中,随着样品的迁移越接近pI时,电流则越来越小。为使各成分能更好
地分离,要保持一定的电功率,就应不断增加电压,电压增高可缩短pH梯度形成,和蛋白质分离所需的时间,但过高的电压会使凝胶板局部范围过热,因此,在电泳过程中,应通冷却水,水温以4-10℃为宜,流量5-10
l/min。一般宽pH范围电泳时间以1.5-2 h为宜。
-
招标采购

-
政策法规
-
政策法规
-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
标准

-
精英视角

-
精英视角

-
招标采购

-
焦点事件

-
焦点事件

-
技术原理
-
焦点事件

-
焦点事件

-
企业风采

-
招标采购

-
焦点事件
-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
产品技术
-
科技前沿
-
会议会展

-
政策法规